金属铜导电性和导热性好,价格低廉,大量应用于各类电子、电器元件[1]。如在装备中大量使用的电连接器,其接触件即是以铜合金作为基底材料外加金属镀层[2]。铜虽具有较好的耐蚀性,但在恶劣环境下仍易发生局部腐蚀现象。铜接触件在实际使用中,由于反复插拔及振动环境会导致接触部位形成缝隙,而高温、高湿、高盐雾的环境易于在部件表面形成电解质液膜,在镀层微孔及破损区会导致局部腐蚀现象的发生[3]。由于此类腐蚀尺寸小、现象细微,对测试手段要求极高且精度难以保证,而数值仿真作为一种新型有效的理论手段,可与试验结果双向结合,探讨腐蚀现象及原理。
目前大多数文献集中于电偶腐蚀仿真,而对于缝隙腐蚀报导较少,且多是关于Fe2+、Al3+等易水解金属离子,有关铜在缝隙中由于镀层破损产生的局部腐蚀现象还未见诸于文献[4-7],因此本文基于COMSOL软件对弱酸性溶液下的此类腐蚀进行仿真,揭示此类腐蚀机理,为实际应用提供参考。
1 几何模型及反应方程式
1.1 几何模型
为简化计算,设定二维几何模型如图1所示。模型下边界为接触件金属部位,上边界为绝缘无通量边界,左侧为与外界空气相连的缝隙口,右侧为缝隙底部。缝隙深度H=4 mm,宽度W=0.2 mm,镀层破损铜裸露区域H1为a=0.25 mm, b=0.05 mm的椭圆形结构,其中心距缝隙口距离H2=2 mm,其余部位为镀层覆盖区域。采用自由三角形网格剖分方式,对下边界及椭圆形节点进行细化网格处理。
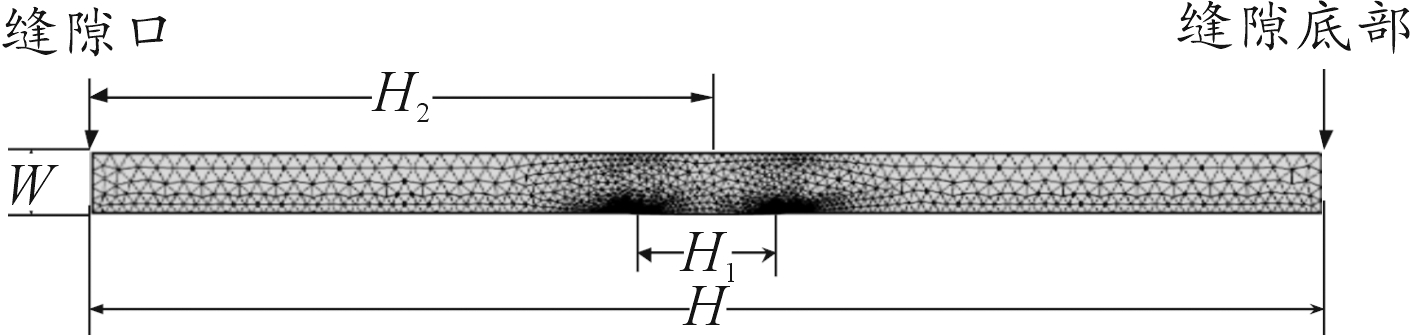
图1 几何模型
1.2 金属表面电化学反应
阳极腐蚀反应仅发生于镀层破损的铜裸露区域,金属整个区域均可发生O2、H+的阴极还原反应。
阳极区铜失电子反应
Cu-2e- → Cu2+
阴极O2、H+还原反应
O2+H2O+4e- → 4OH-
2H++2e- → H2
若处于某一共同电位之下,则在L2区域可同时发生以上3个反应,相应化学当量系数对应关系为每消耗1 molCu、O2、H+分别生成1 molCu2+、4 molOH-及0.5 molH2,生成产物进入溶液中参与化学反应。
1.3 溶液中的化学反应
在弱酸性和中性NaCl溶液中,Cu2+与Cl-发生配位反应,以配合物![]() 的形式存在[8]。
的形式存在[8]。
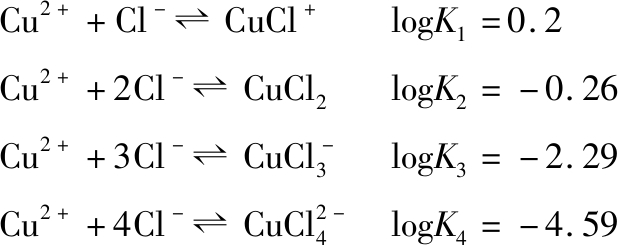
同时也会发生弱水解反应[9-10]
2Cu2++Cl-+H2O 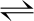 Cu2Cl(OH)3+3H+
Cu2Cl(OH)3+3H+
logK5=-12
还应考虑水的自电离反应:
H2O 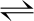 H++OH- logKw=-14
H++OH- logKw=-14
因此,溶液中发生以上6个平衡反应,共包含Na+、Cl-等12种物质,相应物质的参数如表1所示[11]。表中设定Cu2+的初始浓度为10-6 mol/m3,其余产物的初始浓度可由平衡方程求得。
表1 溶液中物质参数
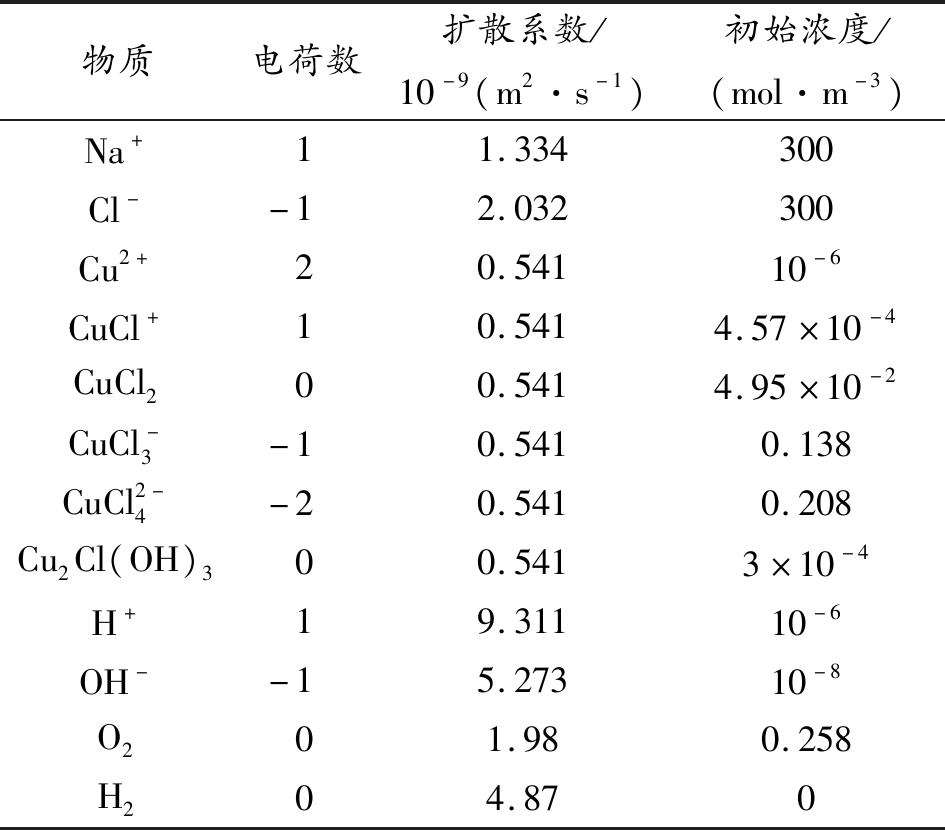
物质电荷数扩散系数/10-9(m2·s-1)初始浓度/(mol·m-3)Na+11.334300Cl--12.032300Cu2+20.54110-6CuCl+10.5414.57×10-4CuCl200.5414.95×10-2CuCl-3-10.5410.138CuCl2-4-20.5410.208Cu2Cl(OH)300.5413×10-4H+19.31110-6OH--15.27310-8O201.980.258H204.870
2 边界条件及求解设定
利用单一动力学公式设定电极-电解质反应边界条件不够贴近实际情况,因此本模型采用三电极测量体系,测定铜在25 ℃,pH=6,0.3 mol/L的NaCl溶液中的极化曲线数据,在软件中以分段线性插值函数表示,作为阳极反应的边界条件,如图2所示。
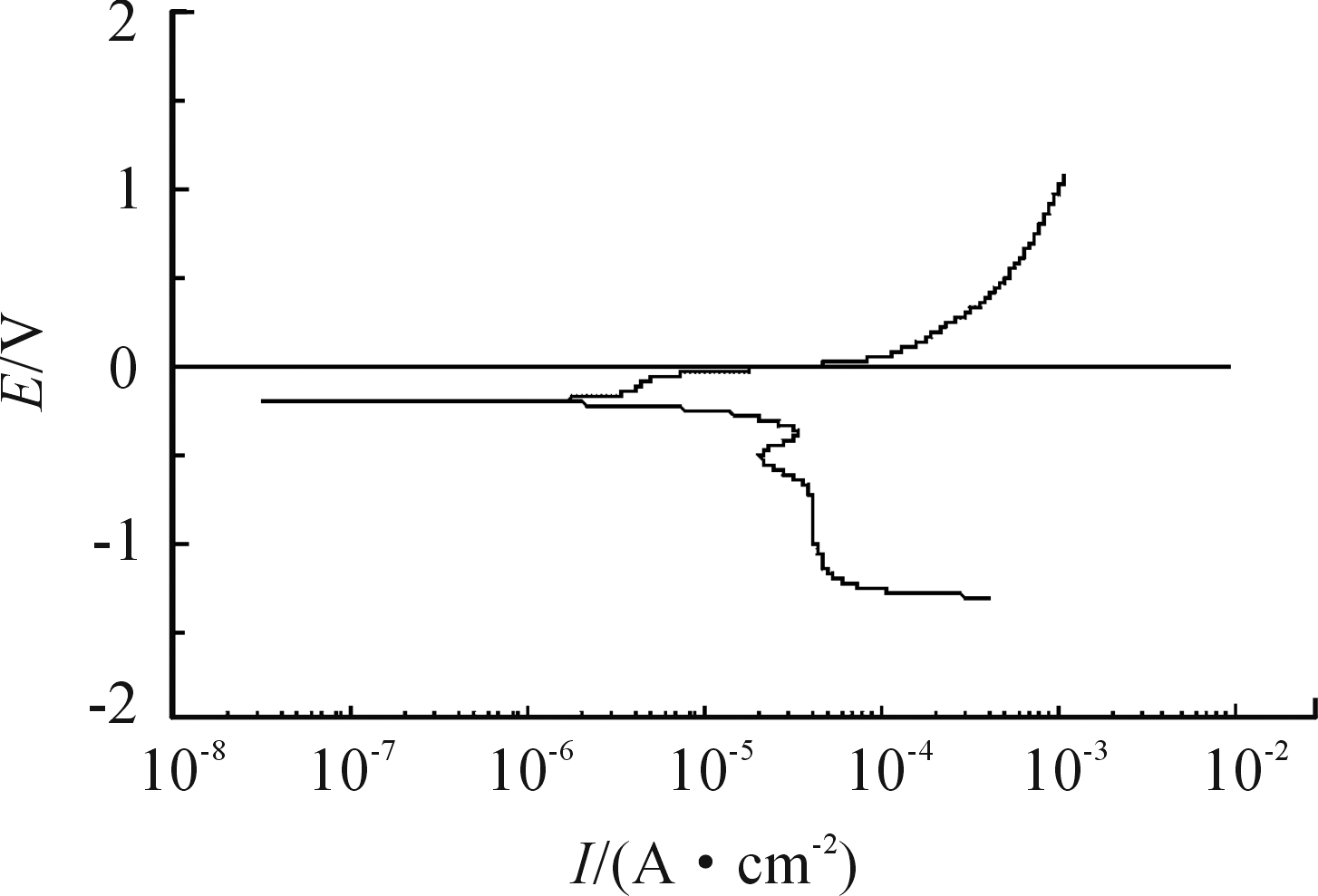
图2 铜的极化曲线
O2、H+的阴极还原反应与物质浓度相关,电极动力学方程满足如下关系[12]
IO2=cO2/cO2,0×iO2,0eηAc,O2
IH2=cH2/cH2,0×iH2,0eηAc,H2
式中: Ii为极化电流密度,A/m2;ci、ci,0分别为反应浓度与初始浓度,mol/m3;ii为交换电流密度,A/m2; η为过电位,V; Ai为Tafel斜率,Ω·m2。
η由下式求得
η=phis-phil-Eeq
式中:phis为金属界面电位,V; phil为溶液电位,V;Eeq为反应平衡电位,V。
相关参数如表2所示。
表2 阴极反应参数
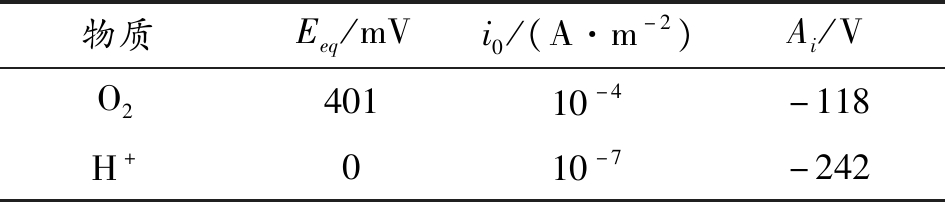
物质Eeq/mVi0/(A·m-2)Ai/VO240110-4-118H+010-7-242
其余边界满足绝缘及无通量条件即法向浓度梯度、电势梯度均为0
-n·Ji=0, -n·is/l=0
缝隙口与外界大气相连,O2浓度为25 ℃下的饱和浓度0.258 mol/m3,缝隙口设为接地,电势为0。
考虑溶液中物质浓度随时间的变化,利用有限元分析方法,采用三次电流瞬态接口研究模型。
3 仿真结果分析
3.1 溶液中电位及电流变化
从图3可看出由于溶液电阻的存在使得溶液电位呈现由缝隙口向缝隙底部逐渐增大的趋势。随着时间的增加,电极反应使得溶液离子浓度增大,但由于存在生成中性产物的平衡反应,使得电位分布相对稳定,缝隙口与缝隙底部保持0.3 mV的电位差。
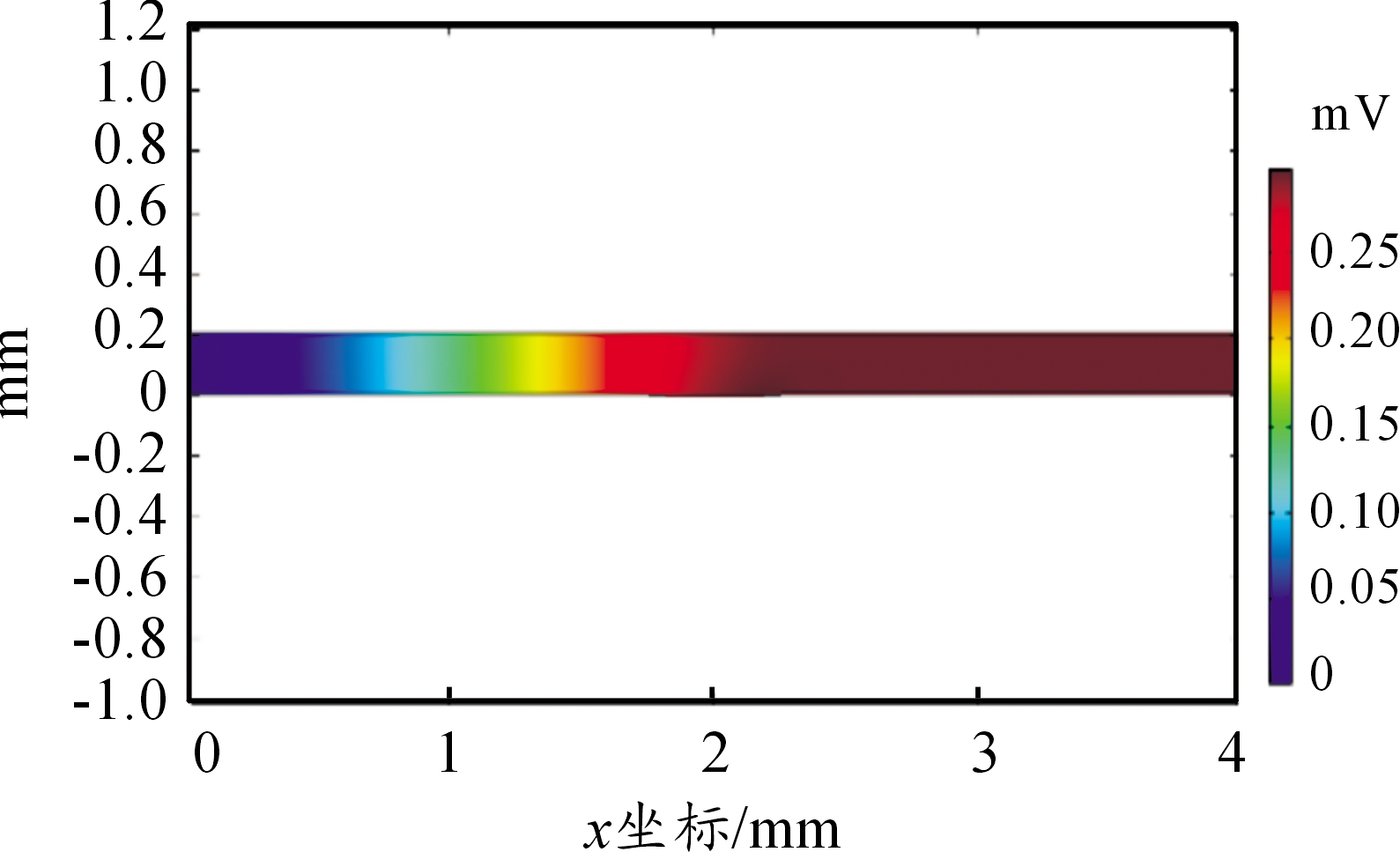
图3 12 h电解质电位分布
缝隙内的电流分布如图4、图5所示,由于溶液中存在的电位梯度使得镀层破损铜裸露区靠近缝隙口的极化电位较高,电流密度呈现由缝隙口向缝隙底部逐渐减小的趋势,但由于尺寸较小,电流密度变化程度十分微弱,镀层破损铜裸露区域发生近似均匀腐蚀。由图5可看出阴极反应主要为氧还原反应,由于受到浓度极化的控制,反应伊始缝隙内的O2即已消耗完毕,使得反应主要集中于缝隙口区域,沿缝隙向内迅速降低接近于0。
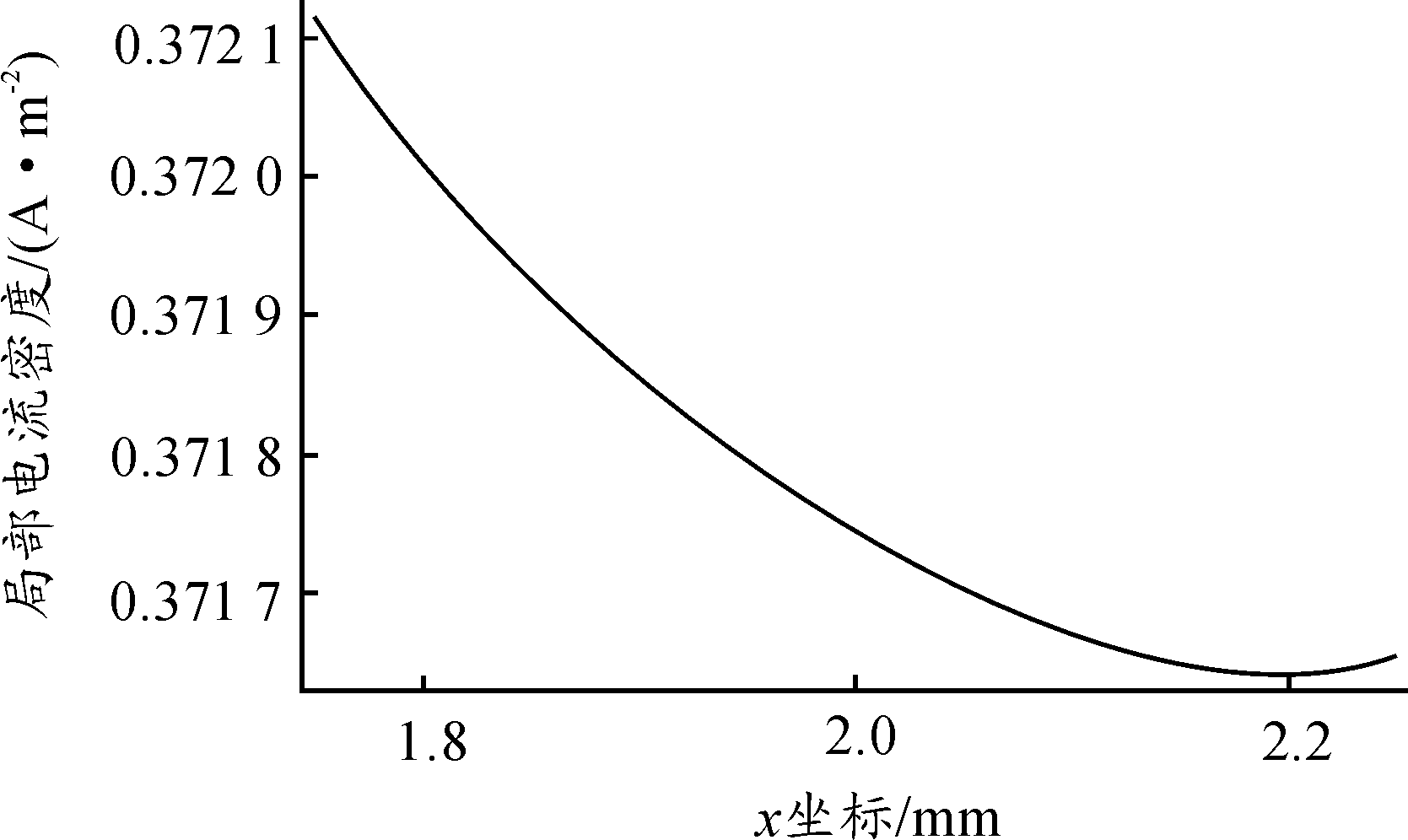
图4 12 h阳极电流密度分布曲线
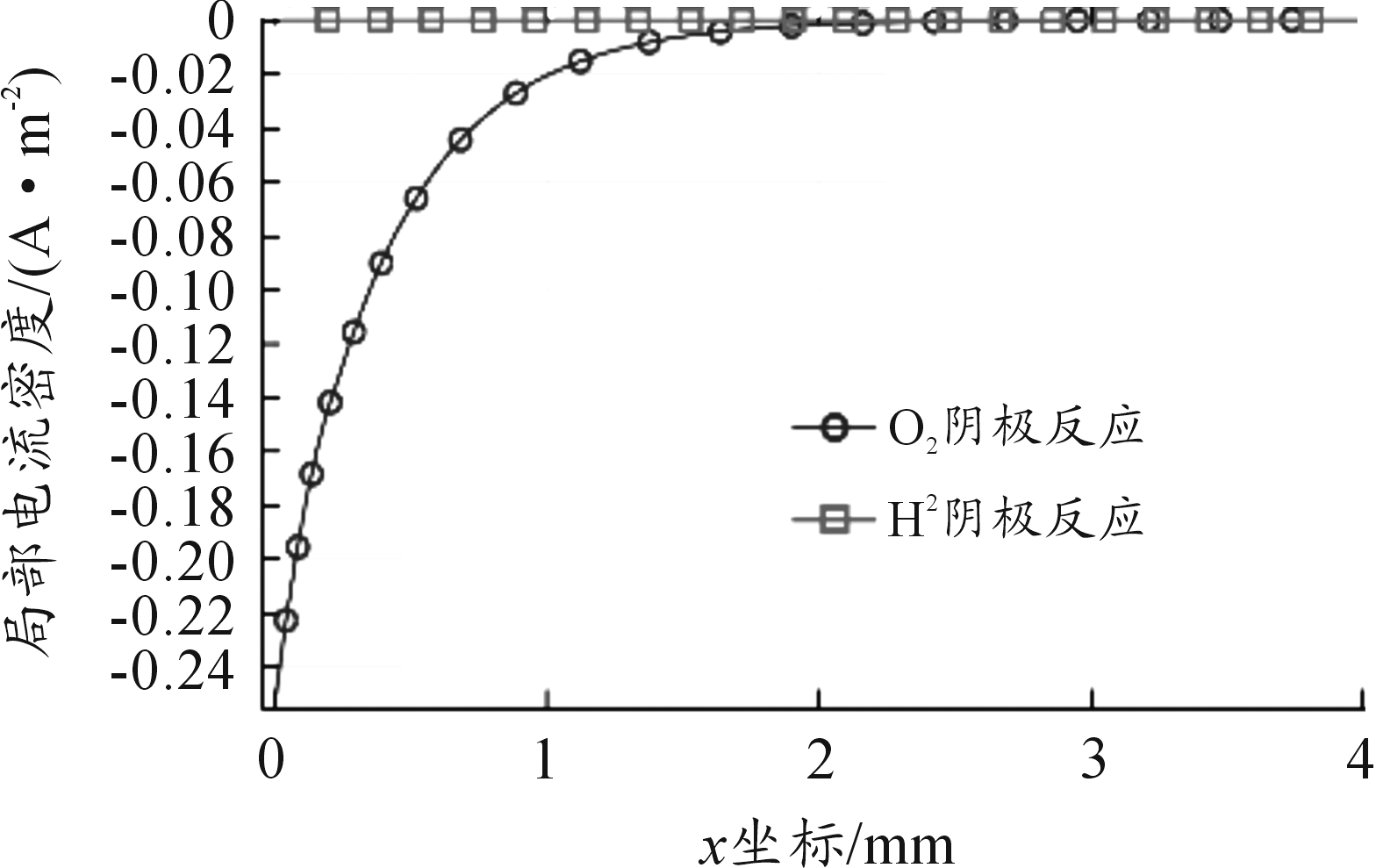
图5 12 h阴极电流密度分布曲线
3.2 溶液中物质浓度变化
图6、图7分别为不同时刻溶液中心截线处pH值分布,从图6可看出,随着反应的进行,溶液逐步向碱性状态转移,24 h以后溶液已不再呈现酸性,溶液H+、OH-浓度满足反比例关系,随着OH-浓度增大,H+浓度减小趋势减弱,因而pH增大趋势也随之有所减缓。图7为12 h溶液中心截线处pH值分布,以阳极反应区为最小值呈对称分布,由于H+在溶液中扩散速率较大,因而pH值分布差距较小。O2还原阴极反应集中于缝隙口,导致缝隙口pH值大于缝隙内部;而阳极区由于Cu2+浓度的增大促进水解发生,使得其pH值呈现最低状态;缝隙底部附近由于H+还原占据主导地位,导致pH值也有所增大。
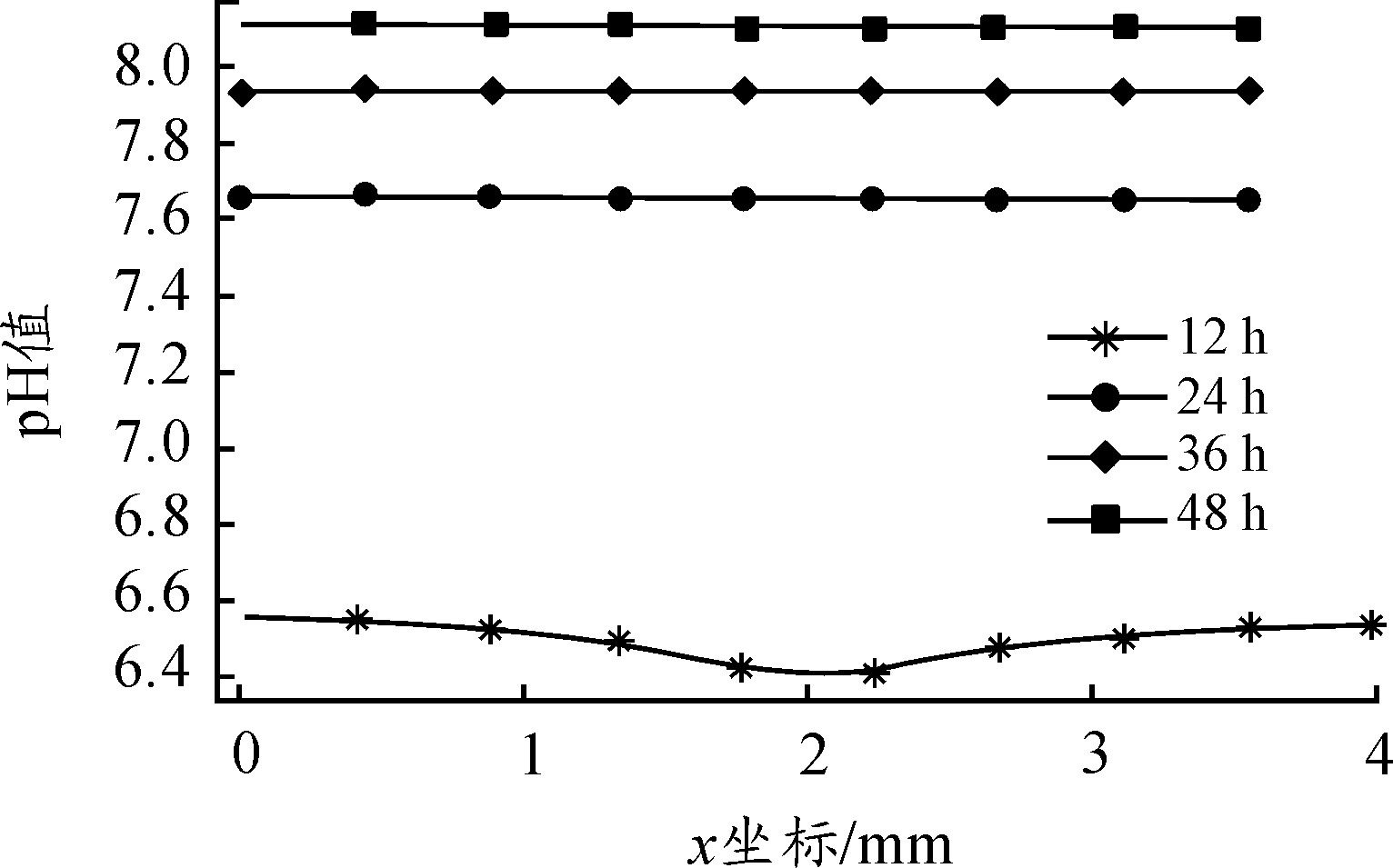
图6 12 h、24 h、48 h、72 h溶液pH值分布曲线
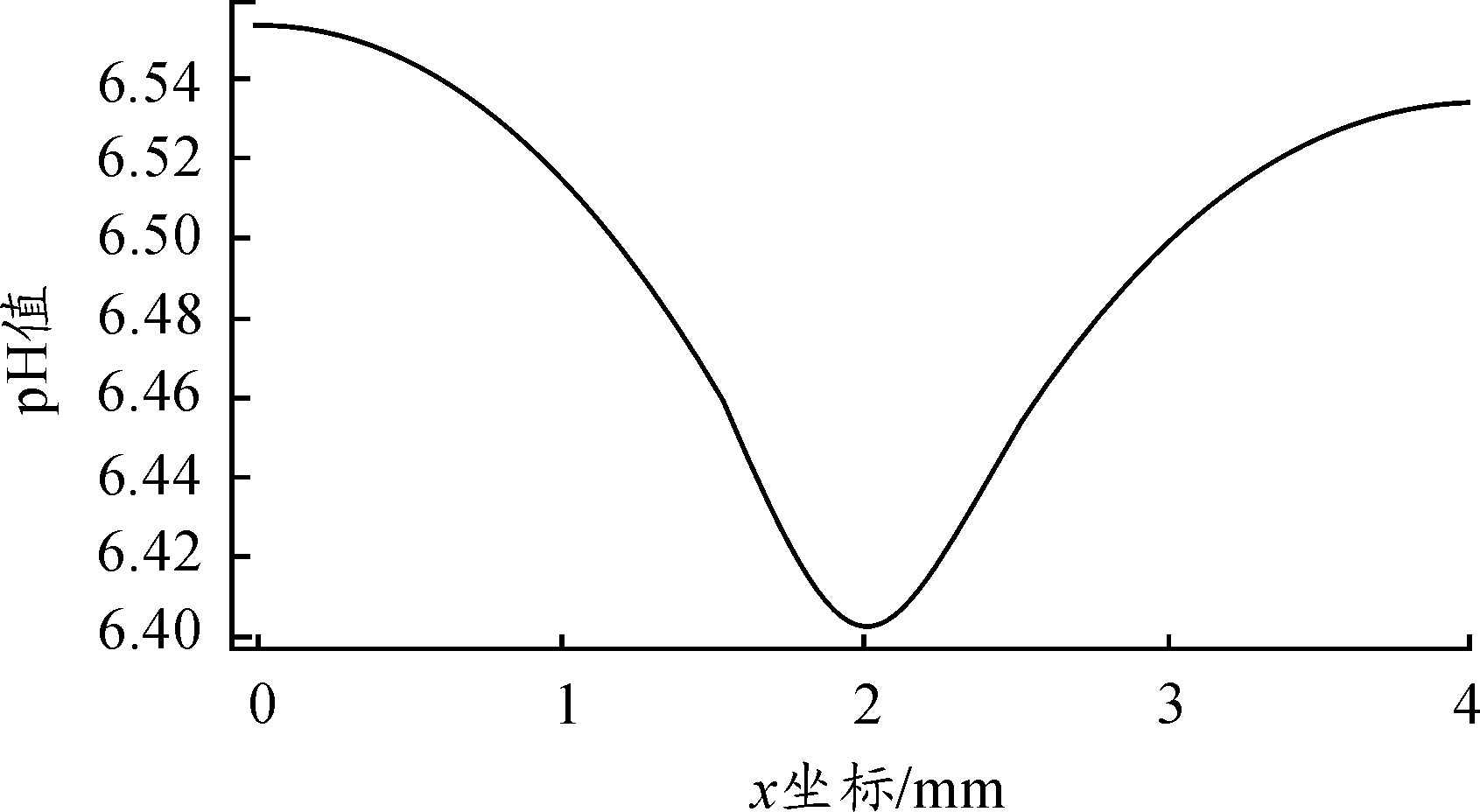
图7 12 h溶液pH值分布
溶液中各离子处于动态平衡过程,图8为腐蚀进行12h时溶液中心截线处Cu2+物质浓度分布,可看出,Cu2+除游离态外绝大多数以Cu2Cl(OH)3和CuCl+的形式存在,其余氯化物由于平衡常数较小,产物极少。中心区域铜腐蚀产生金属阳离子,缝隙口处阴极反应产生OH-,为保持电中性,在电场作用下,阳离子向外迁移,阴离子向内迁移,因而在缝隙口处Cu2+主要以Cu2Cl(OH)3的形式存在。
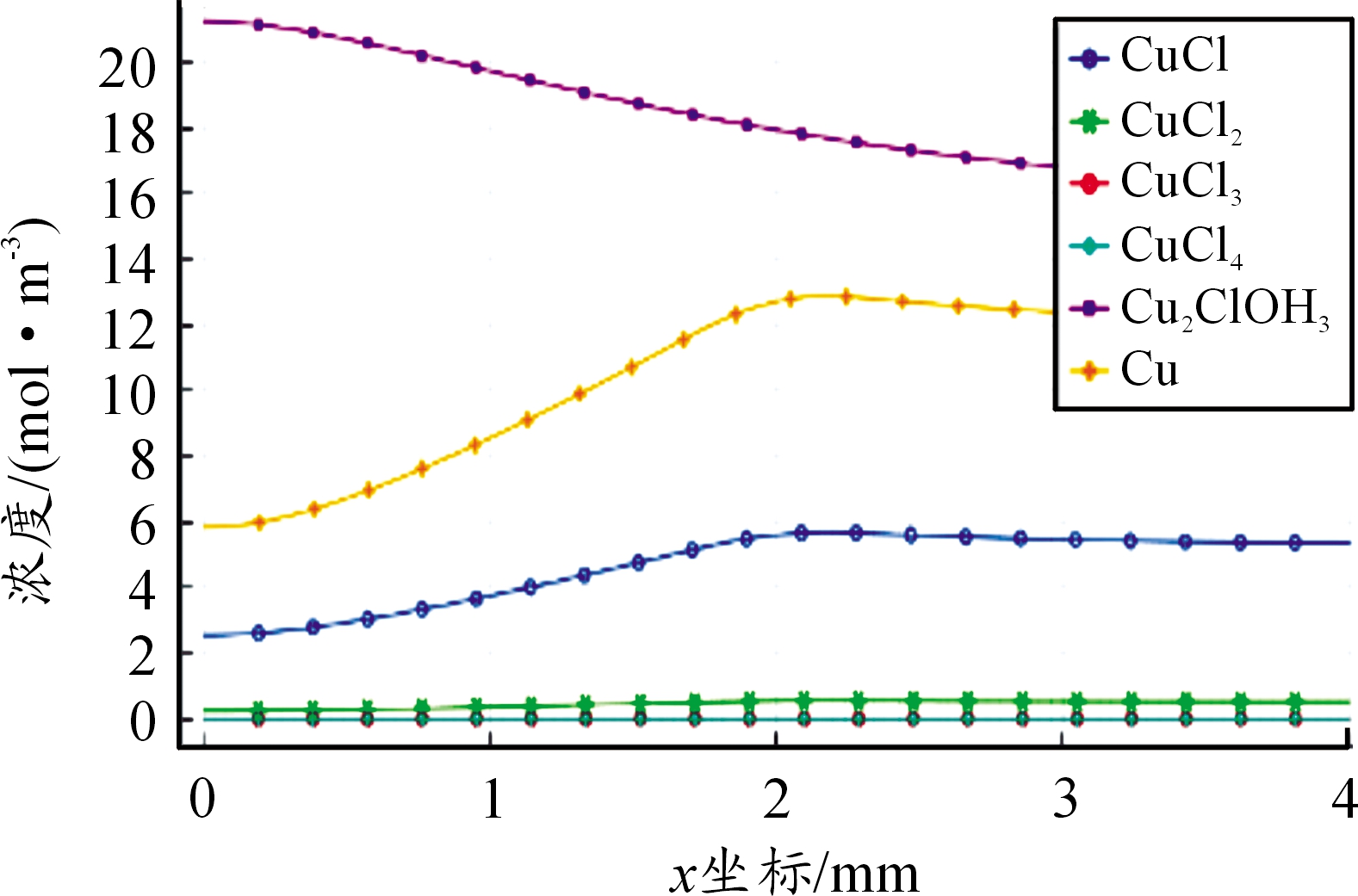
图8 12 h溶液中物质分布曲线
3.3 电位对腐蚀的影响
受实际使用工况的影响,设备部件电位往往会发生变化,尤其以电位升高加速腐蚀最为恶劣,因此采用参数化扫描研究电位对局部腐蚀的影响。
不同金属表面电位下溶液电位分布趋势不变,但电位差急剧增大,外加电位下的溶液电位差如表3所示。由图9、图10可看出电位升高使得阳极反应速率按照Tafel斜率增大,阴极反应迅速减小,缝隙口O2还原电流密度在0.15 V时仅为0 V下的4.8%,由于生成的OH-减少,溶液仍呈现弱酸性,水解反应的正向反应迅速降低,从图11可看出电位升高0.15 V时,溶液Cu2Cl(OH)3平均浓度仅为初始电位下的24.86%,表明电位升高可加速腐蚀,抑制阴极反应,使得氢氧化产物减少。
表3 不同电位下溶液电位差

外加电位溶液电位差0V0.3mV0.15V1.53mV0.3V2.73mV
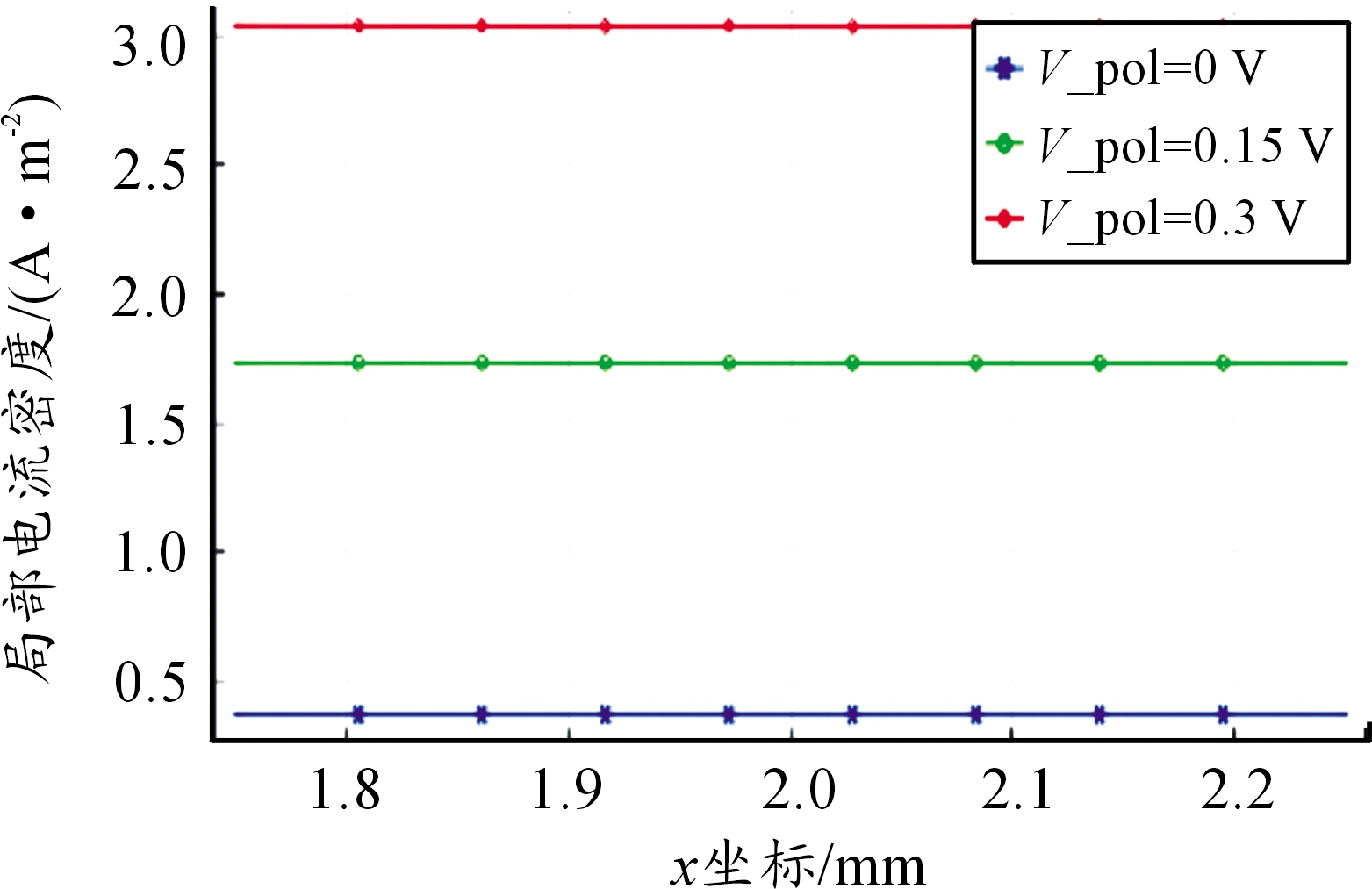
图9 不同电位下阳极电流密度分布曲线
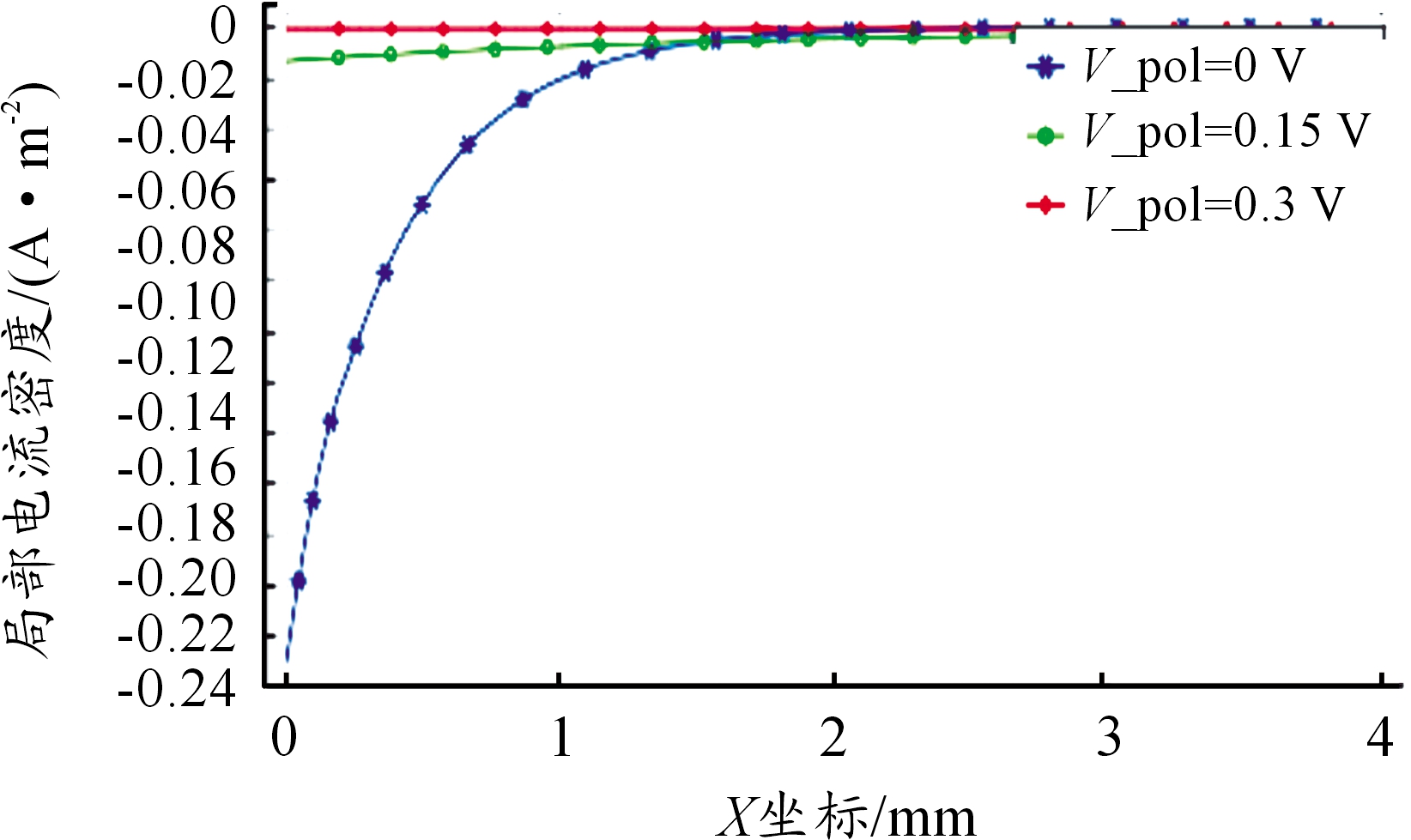
图10 不同电位下O2阴极反应电流密度分布曲线
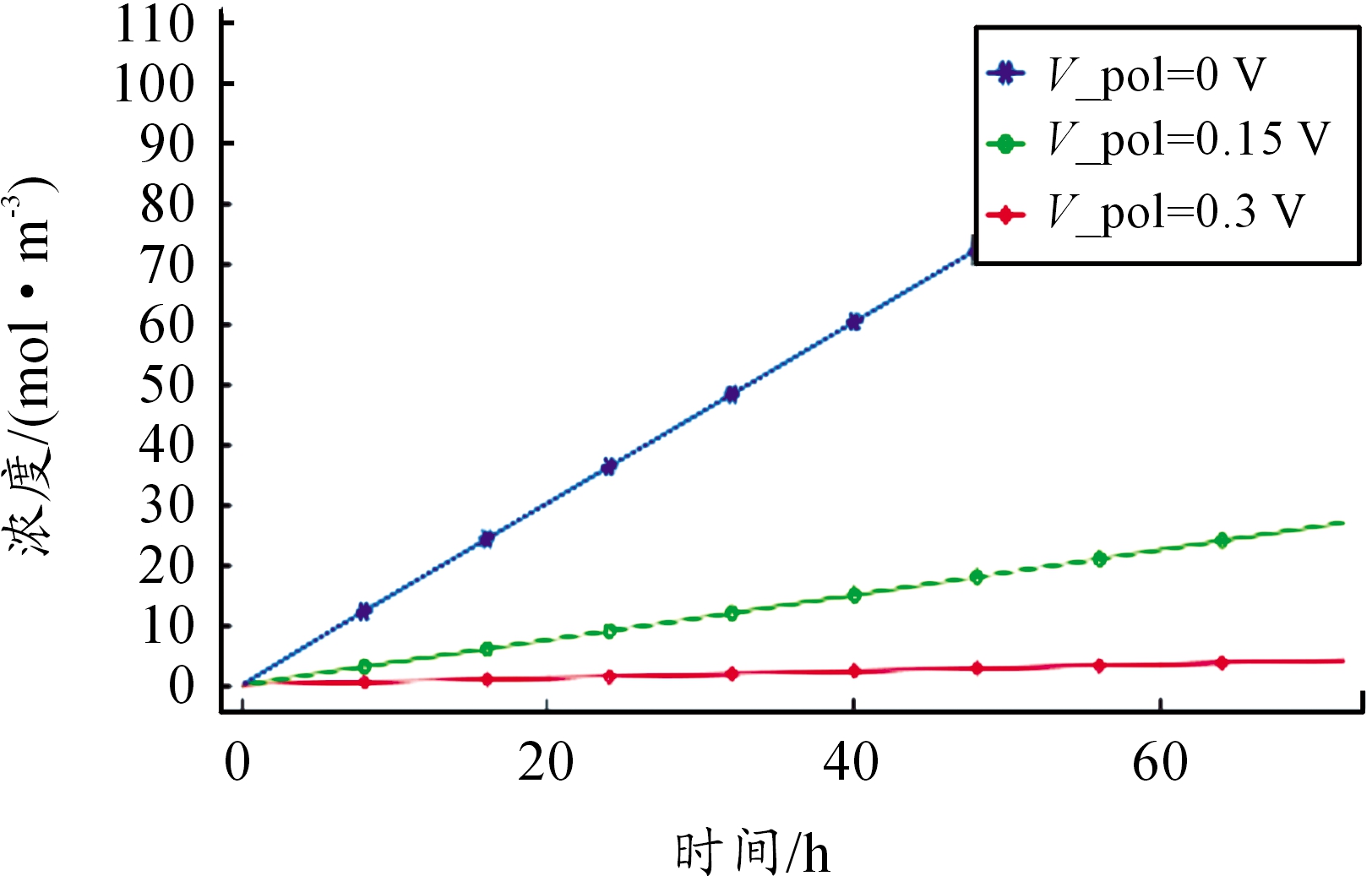
图11 不同电位下Cu2Cl(OH)3平均浓度分布曲线
4 结论
1) 电解质电位及阴阳极电流密度基本处于稳定状态,缝隙口与缝隙底部保持0.3 mV的电位差,阴极反应集中于缝隙口,以O2还原反应为主,阳极区发生均匀腐蚀。
2) 溶液pH值随时间变化向碱性状态转移,表明弱酸性下的腐蚀仅可维持在腐蚀前期。Cu2+在缝隙口主要以Cu2Cl(OH)3的形式存在。
3) 电位升高使得阳极反应加速,抑制了阴极反应,导致氢氧化产物减少。
[1] 杜艳芳,郑欣,郑亚楠,等.金属铜在不同环境下的腐蚀研究[J].材料保护,2016,49(1):81-83.
[2] 郁大照,王琳,唐庆云,等.南海海洋环境下机载电子设备的腐蚀及防护对策[C]//2018第五届装备环境工程发展论坛.哈尔滨:[出版社不详],2018.
[3] 张先勇,舒德学,陈建琼.海南万宁试验站大气环境及腐蚀特征研究[J].装备环境工程,2005,2(4):77-97.
[4] 钟登宽,陈文君,周水峰.ZL205A材料在海洋环境中腐蚀开裂的解决措施[J].兵器装备工程学报,2018,39(11):164-167.
[5] 周淑文,张思奇,刘振洪.危险品收纳车缝隙腐蚀仿真分析[J].公路交通科技,2017,34(2):74-77.
[6] 王晨光,陈跃良,张勇,等.飞机用7B04铝合金缝隙腐蚀试验及仿真研究[J].装备环境工程,2017,14(3):39-46.
[7] TYURIN A G.On the Nature of the Effect of Copper on the CorrosionResistance of Iron[J].Protection of Metals,2004,40(3):232-239.
[8] KOSEC T,MILOSEV I,PIHLAR B,et al.Benzotriazole as an inhibitor of brass corrosion in chloride solution [J].Applied Surface Science,2007,253:8863-8873.
[9] CHEN Z Y,ZAKIPOUR S,PERSSON D,et al.Combined effects of gaseous pollutants and sodium chloride particles on the atmospheric corrosion of copper[J].Corrosion,2005,61(11):1022-1033.
[10] 严川伟,何毓番,林海潮,等.铜在含 SO2大气中的腐蚀初期规律和机理[J].中国有色金属学报,2000,10(5):645-648.
[11] GUSEVA O,SCHMUTZ P,SUTER T,et al.Modelling of anodic dissolution of pure aluminium in sodium chloride[J].Electrochimica Acta,2009,54(19):4514-4524.
[12] DEROSE J A,SUTER T,HACK T,et al.Aluminium Alloy Corrosion of Aircraft Structures[M].Great Britain:WIT Press,2013.