四氮烯衍生物合成研究进展
1 引言
自1772年分离出N2,1890年发现叠氮负离子以来,相较碳化学已经较为成熟的理论和合成方法,氮化学的发展明显落后。近年来大量的研究表明,高氮/碳比及全氮化合物,具有高密度、高生成焓、高能量及分解产物清洁无污染等优点,已成为高能量密度材料新的发展热点。如何高效构筑氮氮键,尤其是对氮链延长反应的研究[1],成为新的挑战和机遇。
小分子肼(N2H4)在航天领域占有重要地位,通常作为一元推进剂被广泛应用在火箭轨道修正、小型卫星推进等。单甲肼1(MMH)、偏二甲肼2(UDMH)作为自燃二元推进剂,与四氧化二氮、硝酸等氧化剂接触即可自动燃烧,被广泛应用在火箭、导弹等推进剂当中。
小分子肼类化合物性质良好、用途广泛,遗憾的是其较大的毒性(纯品致癌)限制了该类化合物的使用。此外,肼类化合物由于较低的沸点、较高的蒸气压,存在与空气混合产生爆炸的危险。因此该化合物储存、操作存在诸多不便。为了避免上述缺点,找到一种性质良好的替代产品迫在眉睫。伴随科学的发展,毒性更小、沸点更高、生成焓更高的四氮烯慢慢步入人们视野。
2 四氮烯衍生物合成研究现状
四氮烯(tetrazene)是指4个氮原子通过2个σ键和一个π键线性连接而成的一类化合物,其分子式为:N4H4。根据文献计算报道[2],四氮烯存在11种可能的异构体,其中最为常见的是2种直链构型,即1-四氮烯3和2-四氮烯4,其结构式如图1。截止目前文献中尚无1-四氮烯3的合成报道,推测其稳定较差,导致难以分离获得。而另一个异构体:2-四氮烯4则进行了更为细致的研究,相关报道层出不穷。后续将围绕2-四氮烯及其衍生物展开详细叙述。
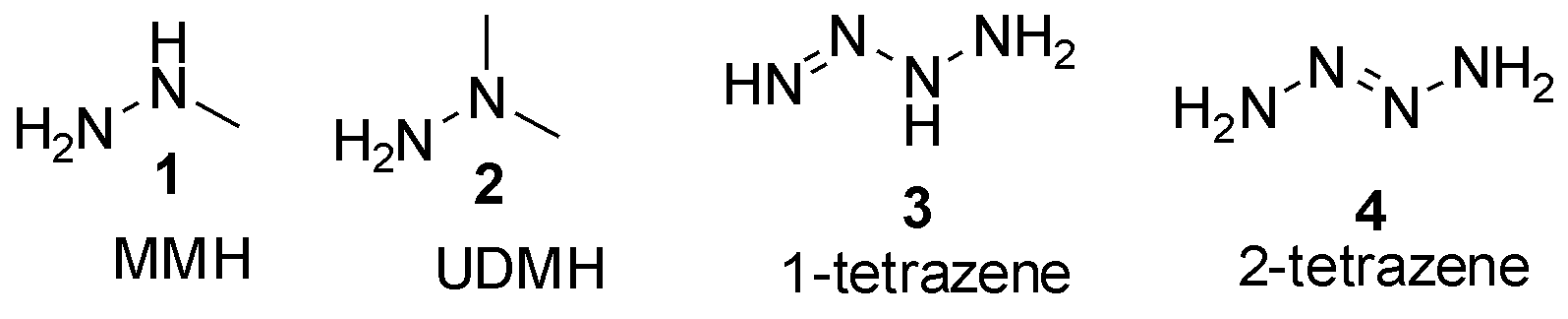
图1 肼与四氮烯结构式
Fig.1 Hydrazines and tetrazenes
2-四氮烯4的合成报道由Bachhuber等[3]在1975年发表,作者通过对双三甲基硅基二亚胺5硅基迁移异构后,得到中间体二硅基取代的氮烯6 [43-44],随后自身二聚得到四硅基保护的四氮烯7,低温三氟乙酸脱除TMS保护,得到2-四氮烯4,如图2所示。但该化合物并不稳定,在0 ℃下会自发分解为N2和肼。
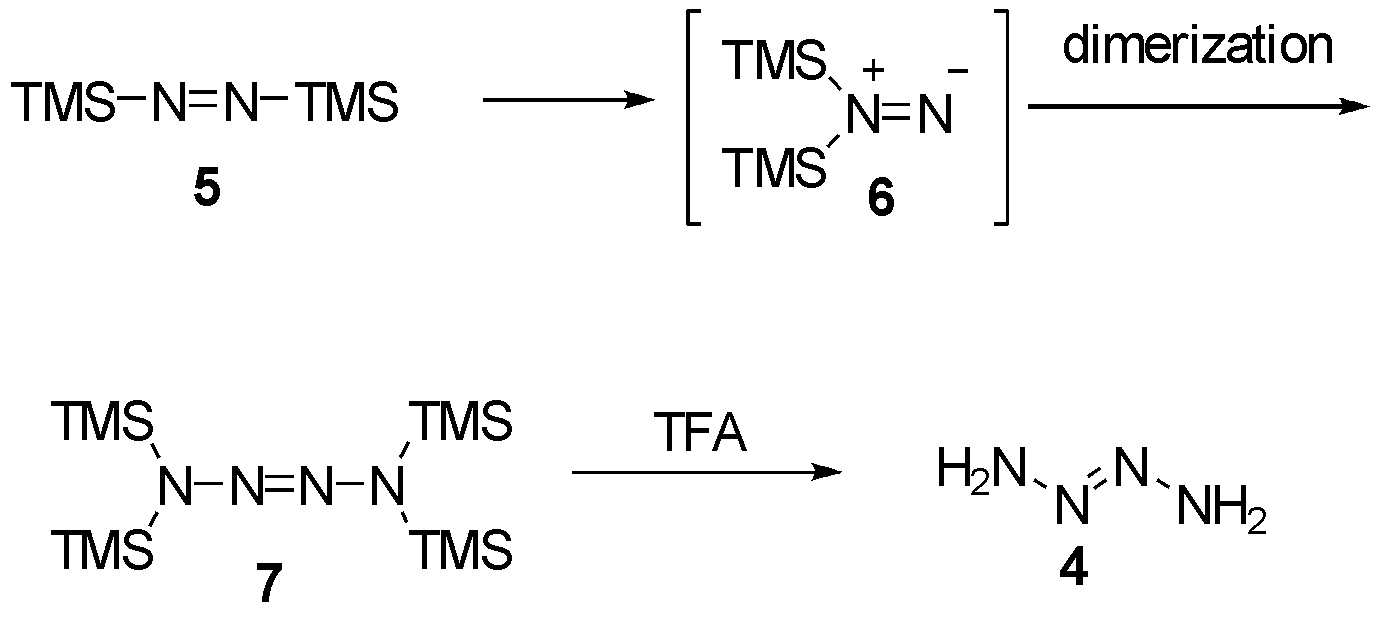
图2 第一例2-四氮烯的合成
Fig.2 First report on the synthesis of 2-tetrazene
末端氢原子取代的四氮烯4稳定性不足,限制了该化合物后续应用测试。当四氮烯末端氢原子被其他官能团取代时(例如烷基,氮杂环等),2-四氮烯结构趋于稳定,解决了室温条件下自身分解的问题。随着含能基团的引入,四氮烯因其高氮/碳比、高生成焓,在含能材料中的应用中展现出广阔的前景,例如Heppekausen小组合成的双四唑二甲基四氮烯[4],以及Li小组报道的4-胺基-1,2,4三唑等杂环取代的四氮烯衍生物[27]。当官能团减小为简单烷烃时,四氮烯由杂环取代的固体,转变为液体,例如1,1,4,4-四甲基-2-四氮烯(TMTZ)[5],在液体推进剂领域具有较好应用前景。
综上所述,研究四氮烯衍生物的合成及性能改进尤为重要,这一领域的深入研究存在较大的难度,受到国内外众多学者的关注,该类化合物新材料的开发已成为国内外研究的新热点。
总结文献后,发现2-四氮烯的合成方法主要为肼类化合物的自身氧化二聚。即肼类化合物8被氧化剂氧化后,得到中间体氮烯8i,随后发生自身二聚得到2-四氮烯9,如图3所示。根据氧化剂类型可以分为无机和有机氧化剂两类。无机氧化剂有重金属盐类(例如HgO、KMnO4、MnO2、Pd(OAc)4等),卤素及其盐类(I2、Br2、NaOBr、KIO3、KBrO3、NH2Cl等)和其他罕见的KH/TMSCl体系、SeO2、PhSeOOH体系。有机氧化剂有SDCI(二氯异氰尿酸钠)、t-BuOCl、BPC(N-苯甲酰胺基过氧甲酸)等,具体反应实例参见第四小节。除了常见的氧化二聚机理,还有罕见的叠氮基与氨基锂反应构筑四氮烯的策略,将在第2.1小节详细介绍。
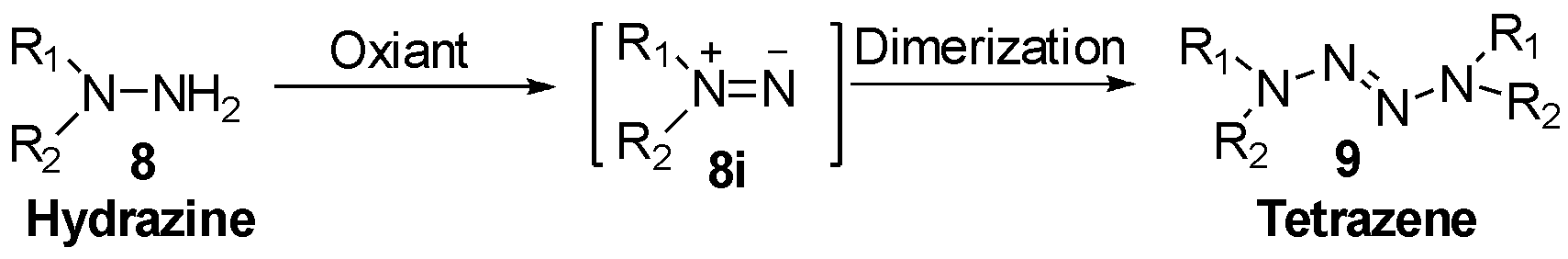
图3 氧化二聚合成四氮烯
Fig.3 The synthesis of tetrazene via oxidative dimerization
综述以2-四氮烯的合成方法为重点,依照其末端官能团分类,将四氮烯衍生物归纳为烷烃取代和杂环取代两类。分别从其合成方法、结构特点、研究历史及其在含能材料中的研究进展进行介绍。希望为新型四氮烯类含能材料的设计与合成提供借鉴与启示。
3 烷烃取代的2-四氮烯研究进展
作为最早出现,较为稳定的四氮烯衍生物,烷烃取代2-四氮烯的研究历史久远。本节首先介绍烷烃取代的2-四氮烯,分为链烷烃取代和环烷烃取代2个小节,详细介绍该类型化合物的发展历史、研究现状及其在含能材料中的应用前景。
3.1 链烷烃取代
链烷烃取代的2-四氮烯首次报道于1956年,McBride等[6]发现偏二甲肼2在中性或弱碱性条件下,利用碘或溴氧化,几乎定量得到四甲基四氮烯9a(TMTZ)。同时作者也观察到不同烷烃取代的1,1-二烷基肼8a~c在酸性条件下换用碘酸钾或溴酸钾,维持低温也可以较高产率得到相应取代的四氮烯9a~c,如图4。遗憾的是当时并未意识到该类化合物的应用潜力。
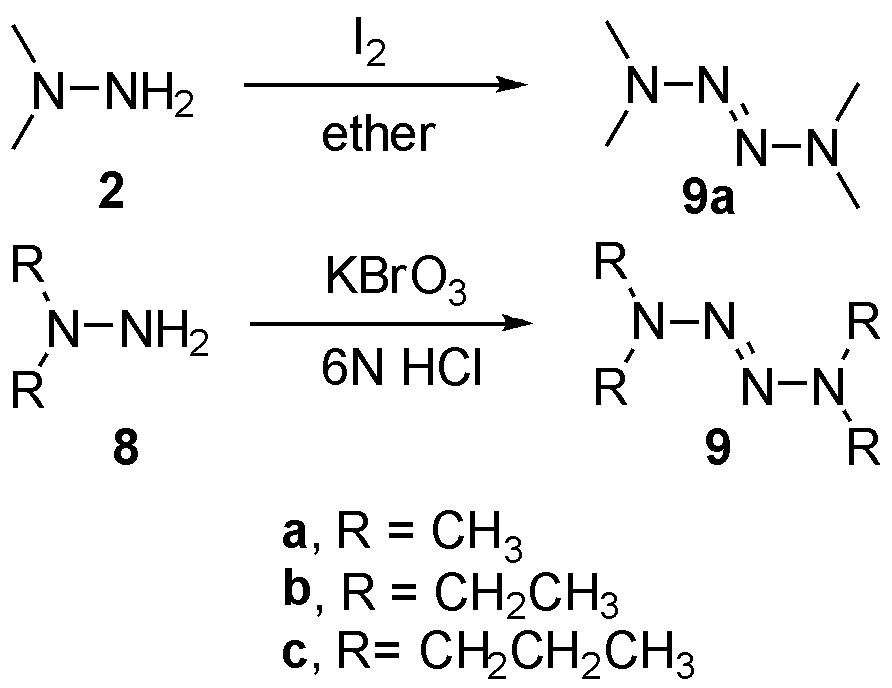
图4 卤素氧化偶联合成链烷烃取代2-四氮烯
Fig.4 The sythesis of chain alkyl substituted 2-tetrazenes via halide oxidative dimerization
1963年,Lemal等[7]发现1,1-二烷基-2-苯磺酰基肼钠盐10a~d,在四乙二醇二甲醚中加热,化合物10热分解后,脱除苯磺酰钠得到中间体氮烯11和12,随后发生氧化二聚得到甲基、乙基、异丙基取代的四氮烯9a~d。其中四乙二醇二甲醚作为溶剂十分关键,换用其他溶剂则无法得到四氮烯产物,如图5。
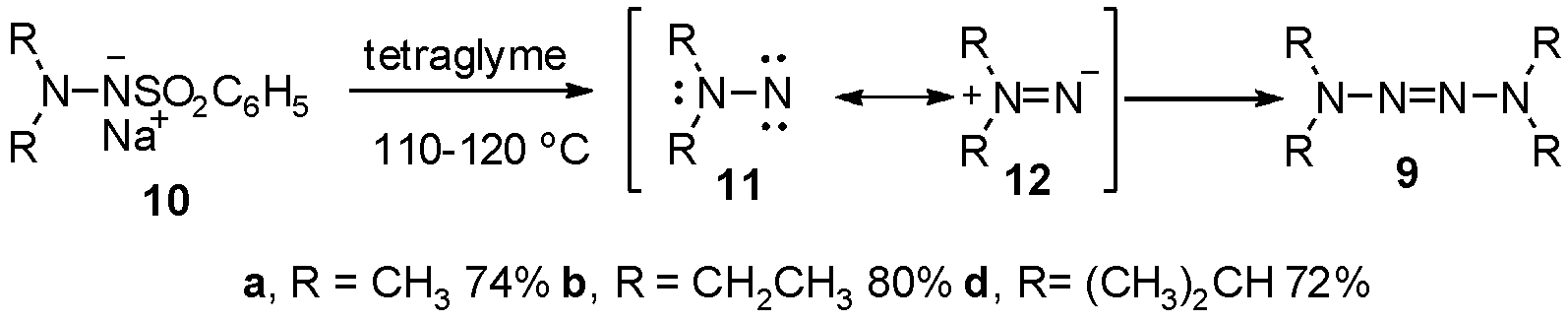
图5 热分解合成链烷烃取代2-四氮烯
Fig.5 The synthesis of chain alkyl substituted 2-tetrazenes via thermal decomposition
2012年,Sabaté等[8]利用偏二甲肼2(UDMH),在乙醚中与氧化汞反应发生二聚,得到四甲基四氮烯9a(TMTZ),随后利用单氯胺得到四氮烯阳离子盐酸盐13,再与不同含能阴离子交换后,共得到6种含能化合物13-18,如图6。计算6种盐的爆轰参数后,发现该类化合物爆速(7 080~7 651 m/s)优于TNT,具有较好的撞感(>15~40 J),摩感(>150~360 J),分解产生有毒气体较少。遗憾的是其能量密度一般(1.320~1.543 g/cm3)。能量密度概念不对,能量密度一般是指密度和爆热的乘积。
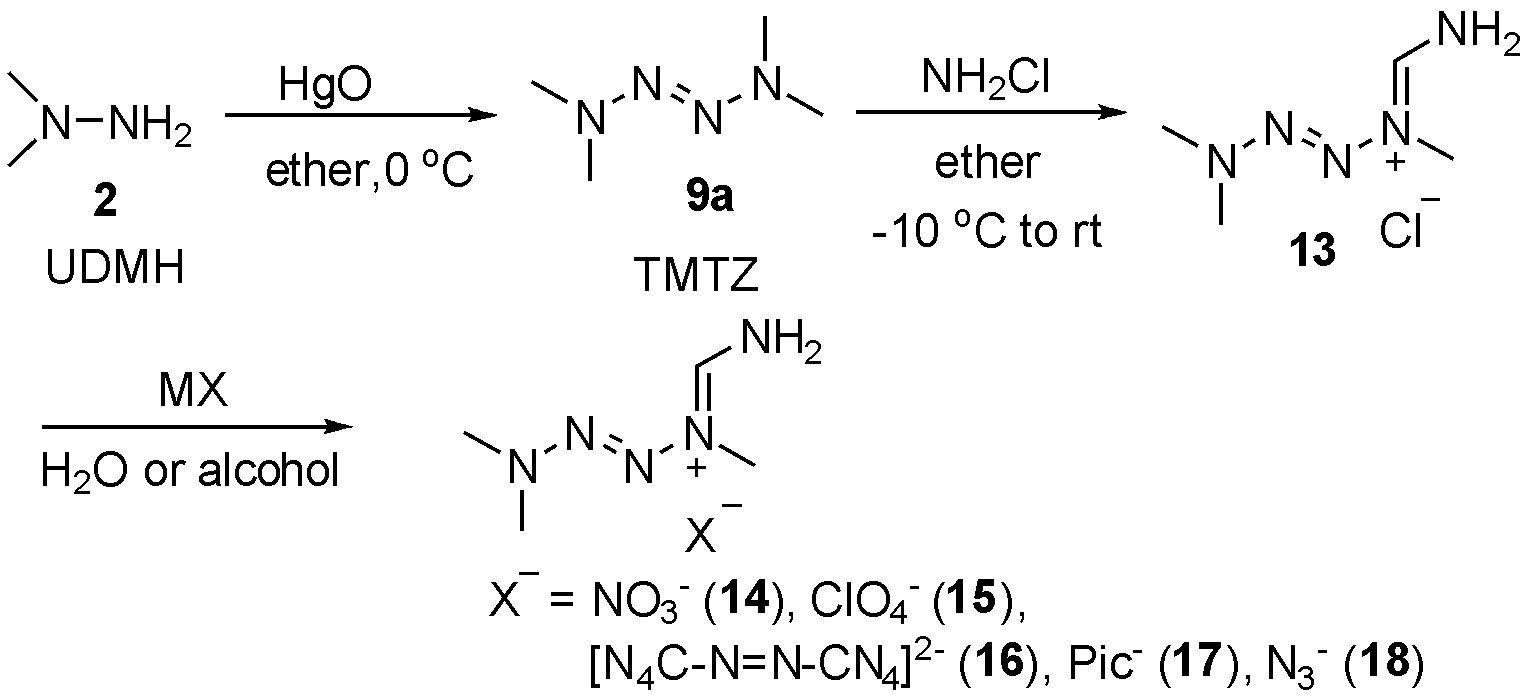
图6 合成四甲基四氮烯及其含能离子盐
Fig.6 The synthesis of tetramethyltetrazene and its energetic ionic salts
2017年,Dhenain等[5]报道了TMTZ的绿色高效合成路线,如图7,解决了过去文献中氧化二聚需要重金属、易燃溶剂等不利问题。作者通过二甲胺19(DMA)在水中被氯胺氨化后得到偏二甲肼2(UDMH),随后在弱碱性的氯胺水溶液中氧化得到中间体氮烯20,绿色高效合成四甲基四氮烯9a(TMTZ),并计算了TMTZ的气相生成焓数据(214 kJ/mol)。除了该路线具有较好的工业应用前景,更重要的是作者研究了TMTZ作为推进剂时,展现出与单甲肼(MMH)等常见肼类推进剂相似的比冲性能,且具有不易挥发、毒性小等优良性质。2018年,作者对TMTZ的细胞毒性进一步探索[9],证明了该化合物对人体及动物细胞无毒害的优点。显而易见,TMTZ已成为替代易挥发、高毒性肼类航天推进剂的优良候选化合物。
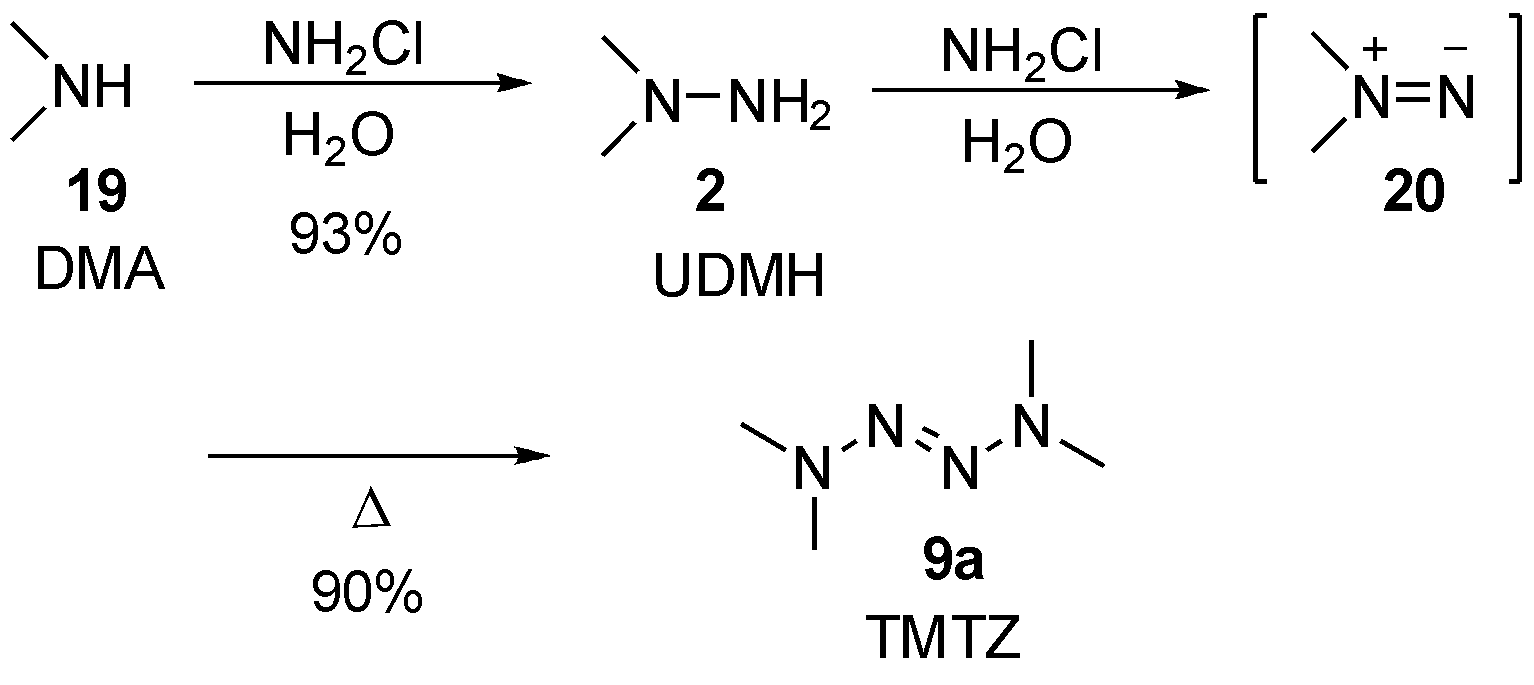
图7 绿色高效合成TMTZ
Fig.7 Green and efficient synthesis of TMTZ
可以看到,文献报道的四氮烯绝大多数为trans构型,cis构型的四氮烯引起了有机化合成学家的兴趣。1970年Nelsen等[10]尝试利用化合物21得到分子内氧化偶联的产物cis-2-tetrazene 23,然而出人意料地得到了12元环产物22。经过一系列鉴定,作者推测12元环的构型仍为trans,由此可见cis构型的产物合成存在较大挑战,如图8。
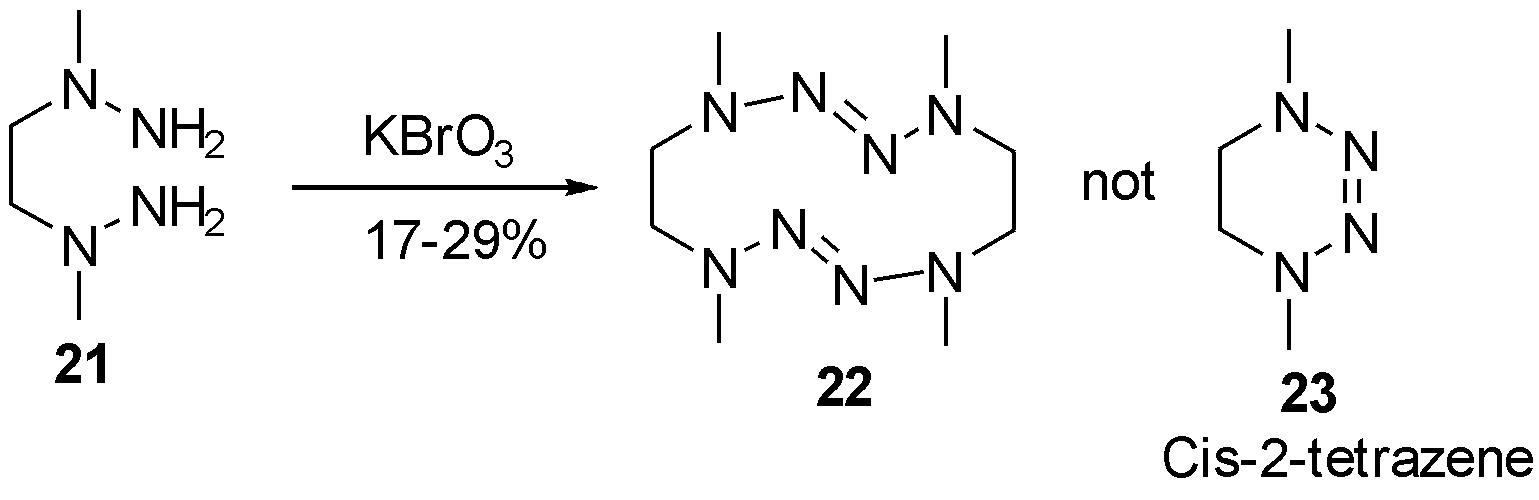
图8 12元环四氮烯22的合成
Fig.8 The synthesis of 12-member cyclotetrazene 22
cis-2-四氮烯的报道出现在1978年,Seebach等[11]另辟蹊径,从亚硝酸二甲胺24出发,利用二异丙基氨基锂(LDA)夺氢后得到25,发生碳端自由基负离子氧化偶联关环,随后碱金属还原亚硝胺得到氮端自由基阴离子,发生自由基偶联得到化合物26,最终通过有机膦试剂或锂铝氢还原,得到cis构型的2-四氮烯23,如图9。
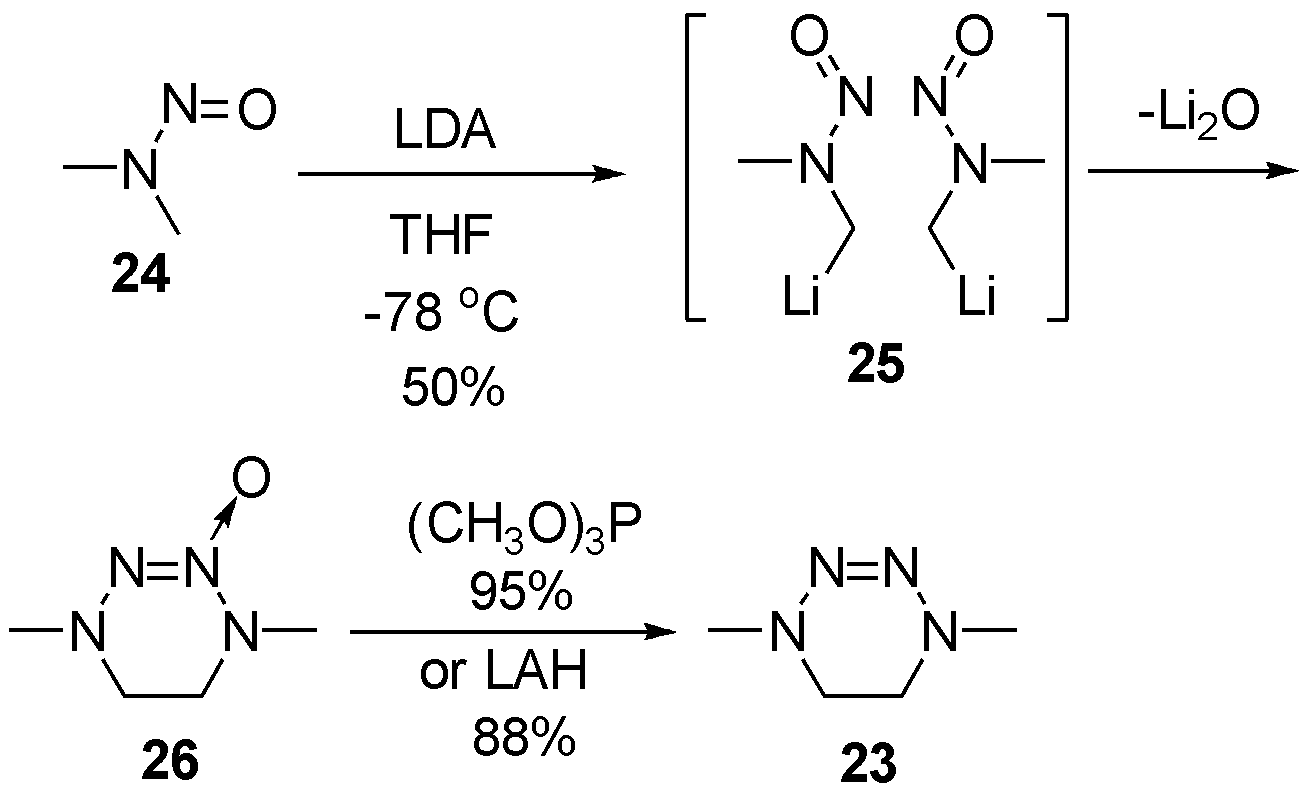
图9 利用LDA合成顺式-2-四氮烯21
Fig.9 The synthesis of cis-2-tetrazene 21 by LDA
3.2 环烷烃取代
环烷烃取代的四氮烯研究,起步略晚于链烷烃取代。由于环状化合物存在环张力,环烷烃取代的四氮烯,拥有更好的爆轰性能,本小节详细介绍环烷烃类型2-四氮烯的合成实例。遗憾的是在早期文献报道中,该类化合物爆轰性能并未引起化学家的重视。
1963年,Lemalt等[12]报道了氧化汞在乙醚中将N-氨基吡咯烷27氧化二聚为四氮烯28的实例,而N-氨基-2,5-二甲基吡咯烷29则通过高锰酸钾、丙酮作溶剂,氧化为相应的四氮烯30,如图10。
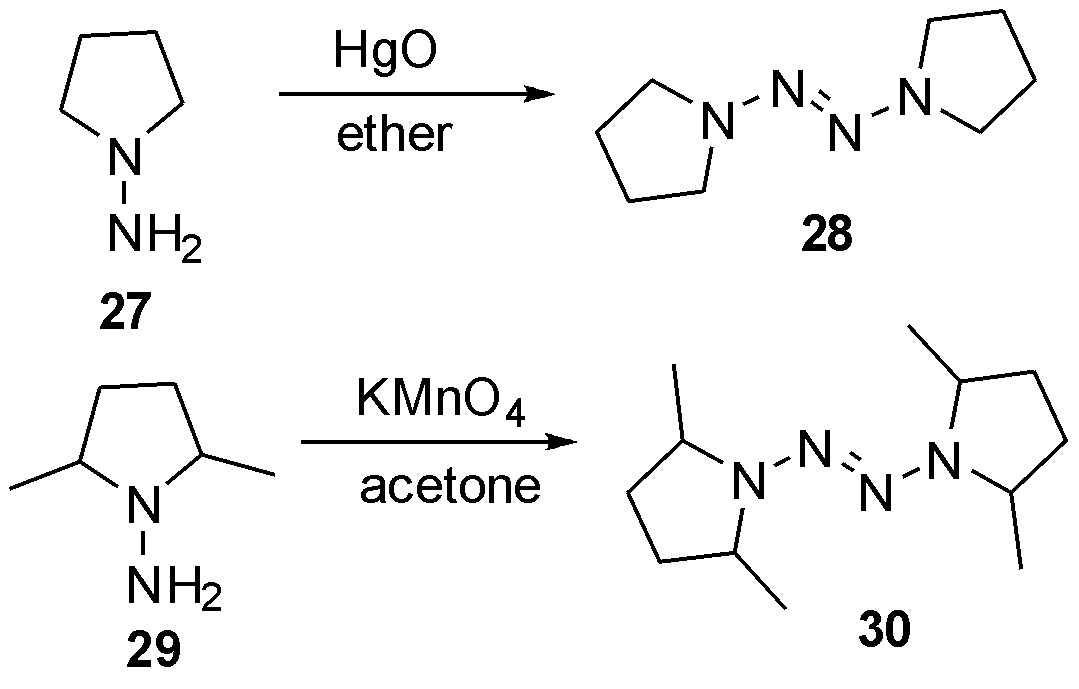
图10 利用重金属氧化合成环烷烃取代四氮烯
Fig.10 The synthesis of cycloalkyl substituted tetrazenes via heavy metal oxidant
1968年,George等[13]发现利用二氧化锰也可将肼氧化二聚为相应的四氮烯。N-氨基哌啶31等化合物溶于苯后,与二氧化锰在室温下搅拌,即可得到相应的环烷烃取代四氮烯32。当底物更换为苄基取代的肼33时,需在乙醇中回流方可中等收率得到四氮烯34,如图11。
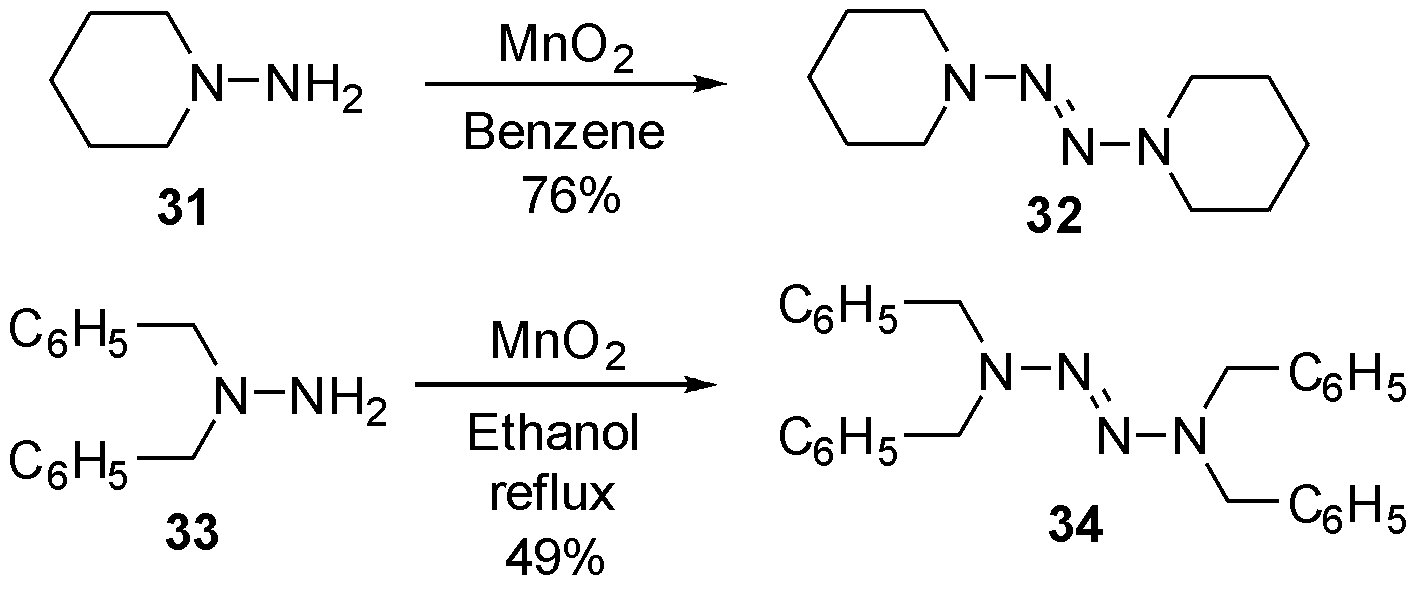
图11 利用二氧化锰合成2-四氮烯衍生物
Fig.11 The synthesis of 2-tetrazene derivatives by MnO2oxidation
1975年,Hoesch等[14]报道了利用醋酸铅为氧化剂,得到四氮烯36的策略。其中快速加入醋酸铅十分关键,有利于提高四氮烯产率。而缓慢加入氧化剂,化合物35则转化为邻苯二甲酰亚胺。随后1986年,Milcent等[18]同样利用四醋酸铅氧化肼类化合物37二聚得到四氮烯38,如图12。
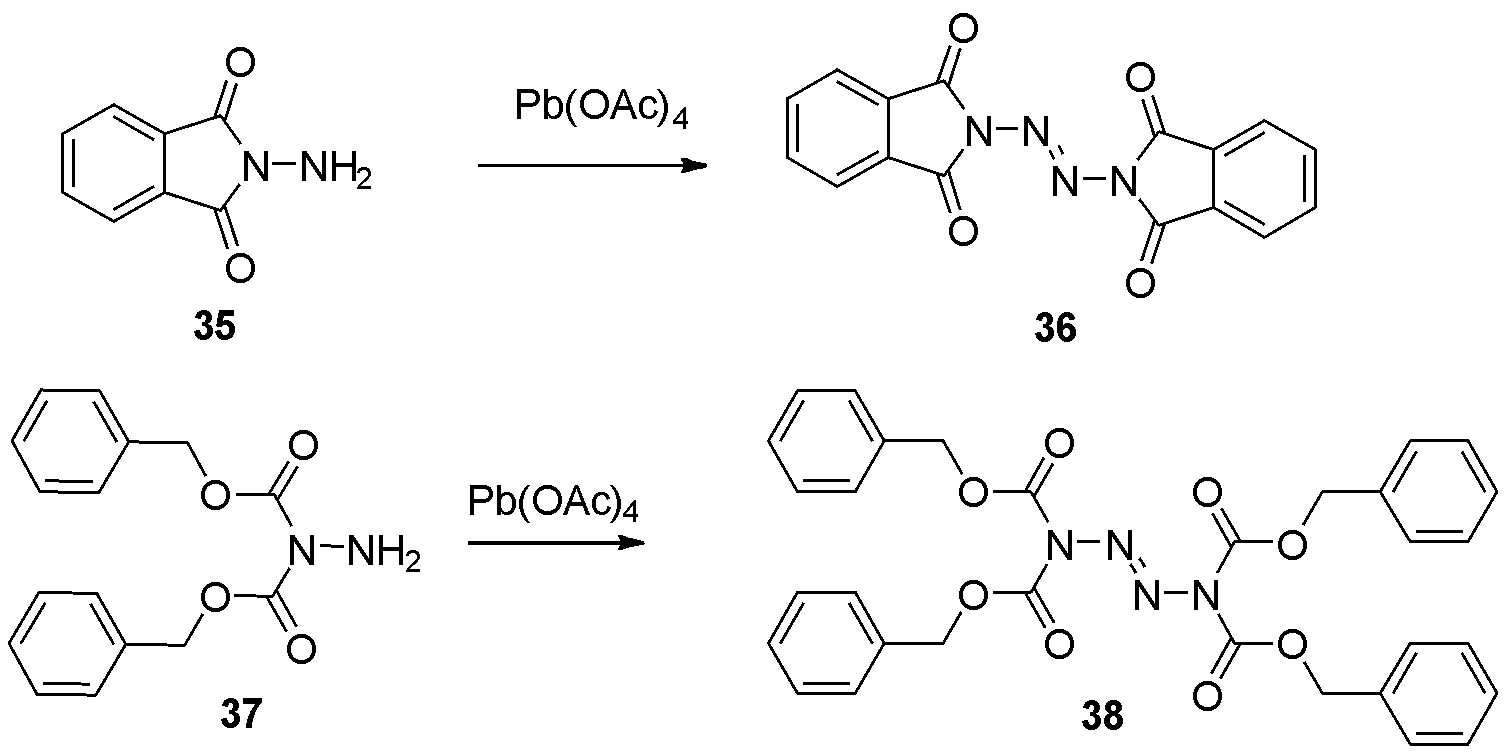
图12 利用四醋酸铅合成2-四氮烯衍生物
Fig.12 The synthesis of 2-tetrazene derivatives by Pb(OAc)4oxidation
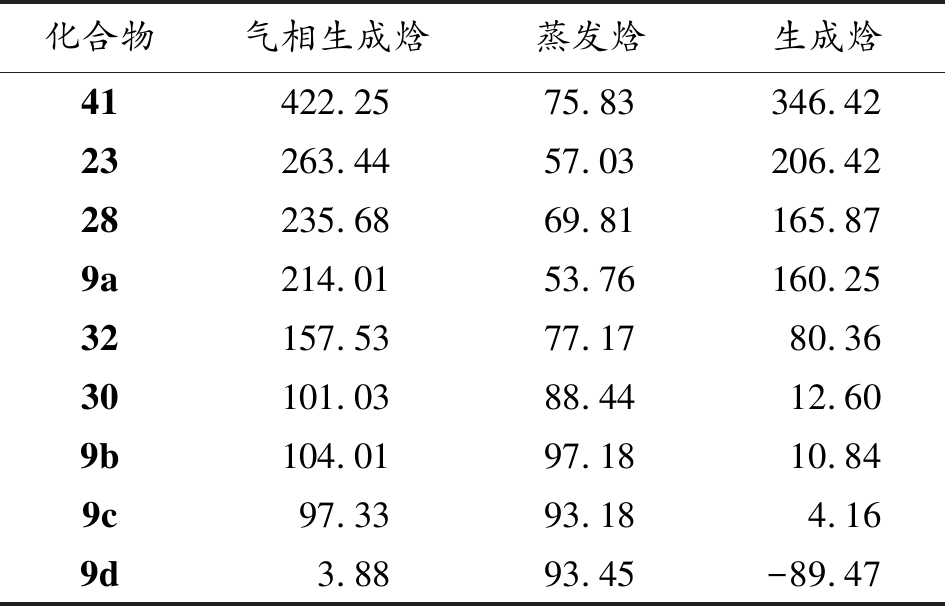
1978年,Rademacher等[15]报道了从氮杂环丁胺39出发,在羟胺磺酸的条件下得到肼40,随后在碘的氧化下,得到氮杂环丁胺四氮烯41,如图13。尽管该化合物爆轰参数报道缺失,但本研究中认为拥有大张力四元环取代的四氮烯41,可能拥有更高的生成焓数据。为此,在本节末尾对部分结构具有代表性的四氮烯生成焓理论计算,验证了这一推论的正确性。
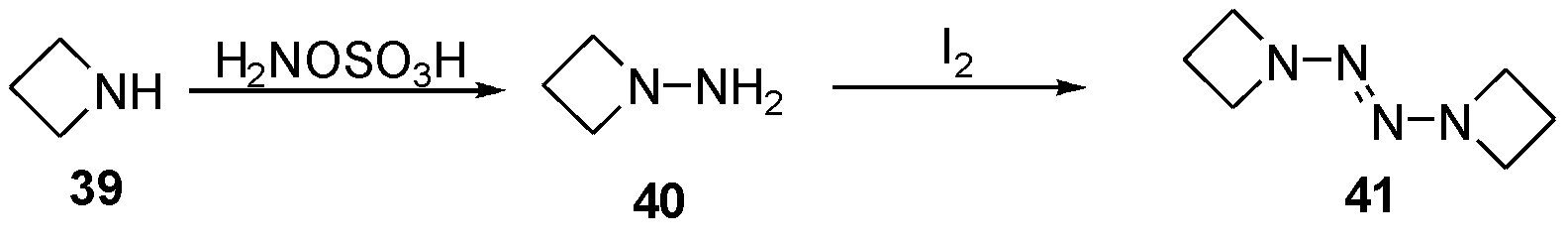
图13 从环丁胺39合成2-四氮烯41
Fig.13 The synthesis of 2-tetrazene 41 from azacyclobutylamine 39
1982年,Back等[16]报道了利用苯硒酸氧化1,1-二取代肼42二聚为四氮烯的策略。该策略条件温和,产率较高。经过底物筛选,当取代含有大位阻基团时,如芳基、对甲苯磺酰基等,相应四氮烯受到位阻影响,产率明显降低。含氧杂环43d和43e,同样适用此方法。与此同时,二氧化硒也可用于类似转化,但产率略差于苯硒酸。四甲基四氮烯(TMTZ)也可使用该方法合成,产率较低,如图14。
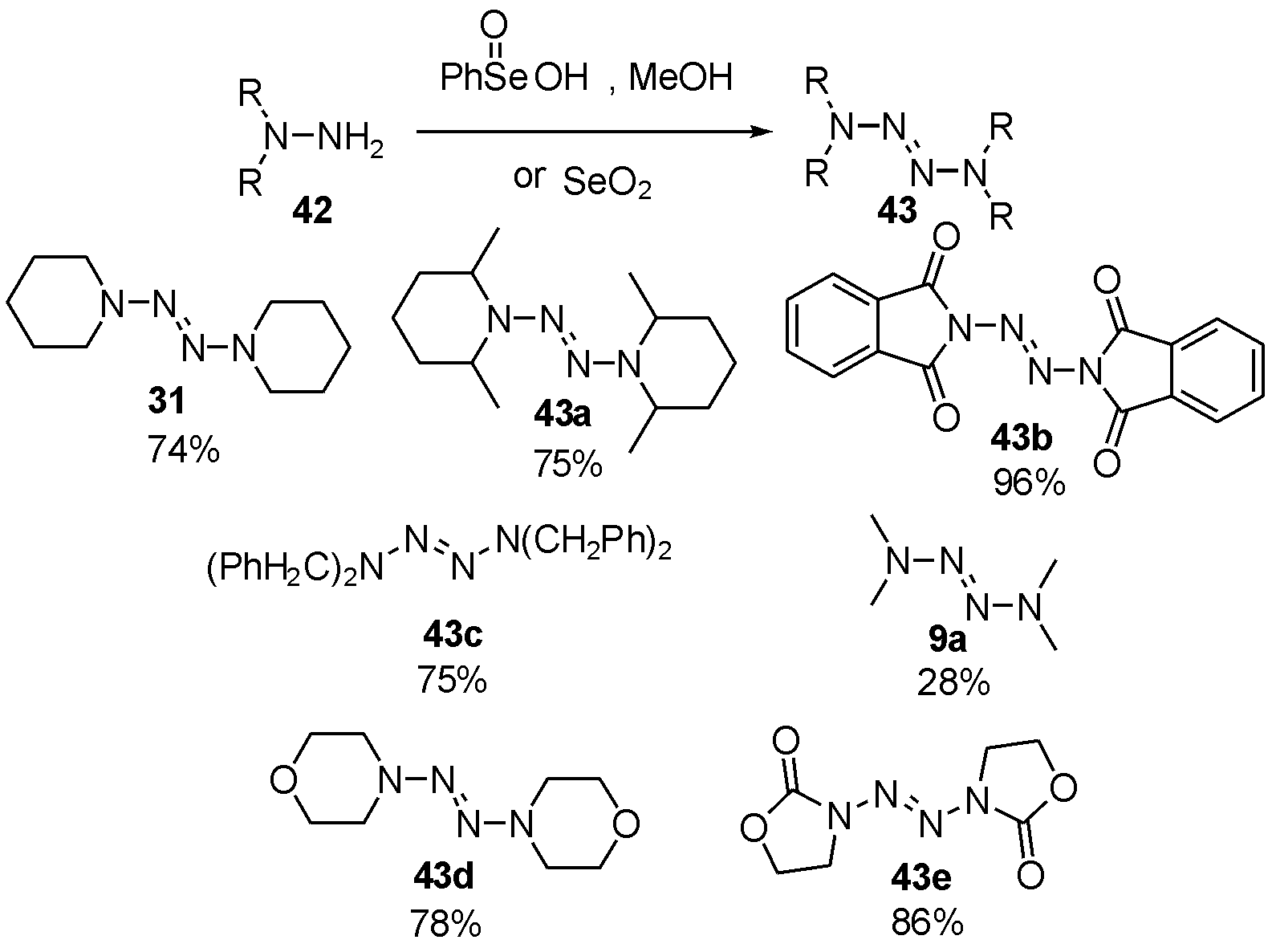
图14 利用苯硒酸或二氧化硒合成2-四氮烯衍生物
Fig.14 The synthesis of 2-tetrazene derivatives via PhSeOOH or SeO2
1986年,Heesing等[17]在研究桥环胺的反应性质时,发现了利用氯胺乙醚溶液,可将桥环胺44一步氧化为四氮烯45。本文中特别强调了氯胺在中性条件下分解严重,在碱性条件下相对稳定的特性,如图15。
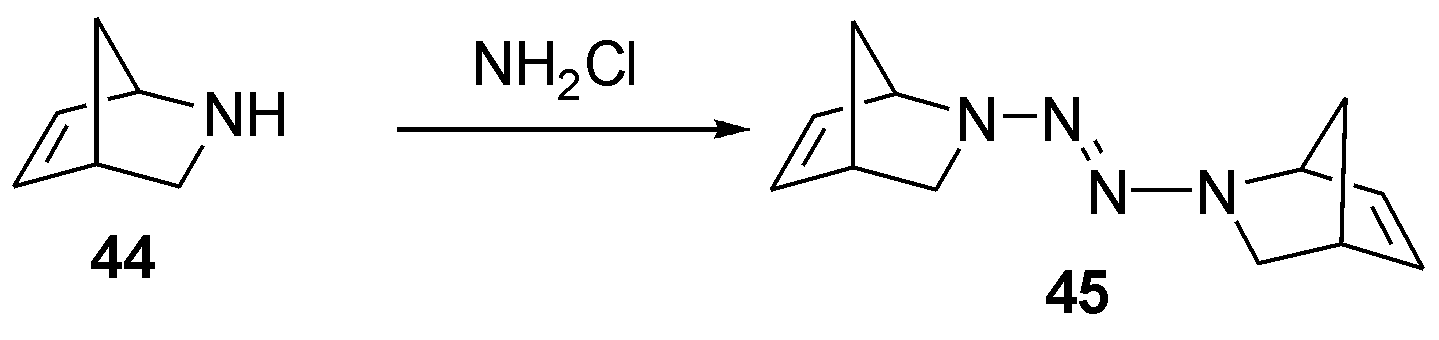
图15 利用氯胺一步合成桥环胺2-四氮烯
Fig.15 The One-pot synthesis of bridged cycloamino 2-tetrazene by chloramine
1987年Trogler等[19]报道了合成四氮烯全新的方法:叠氮负离子与锂试剂得到四氮烯的策略。在前人合成2-四氮烯均使用氧化策略的背景下,作者认为负离子在成键上有较好的活性,有机会获得四氮烯结构。作者利用苯基叠氮46与丁基锂交换后的苯胺盐47反应得到中间体48,低温下再次加入丁基锂得到锂盐49,最后加入碘甲烷,即可获得苯基甲基取代的四氮烯50。该策略的成功,为合成不对称四氮烯衍生物奠定基础,如图16。

图16 利用叠氮/锂盐构筑N-N键策略合成2-四氮烯
Fig.16 Synthesis strategy of 2-tetrazenes by azide anion/lithium N-N bond formation
1988年Paredes等[20]利用N-苯甲酰胺基过氧甲酸(BPC)氧化切断腙51希望得到氧杂吖丙啶54时,意外得到了副产物四氮烯52。作者推测54氧化断键后形成了中间体55,发生氧化二聚得到52,以及对中间体继续氧化的化合物53,如图17。
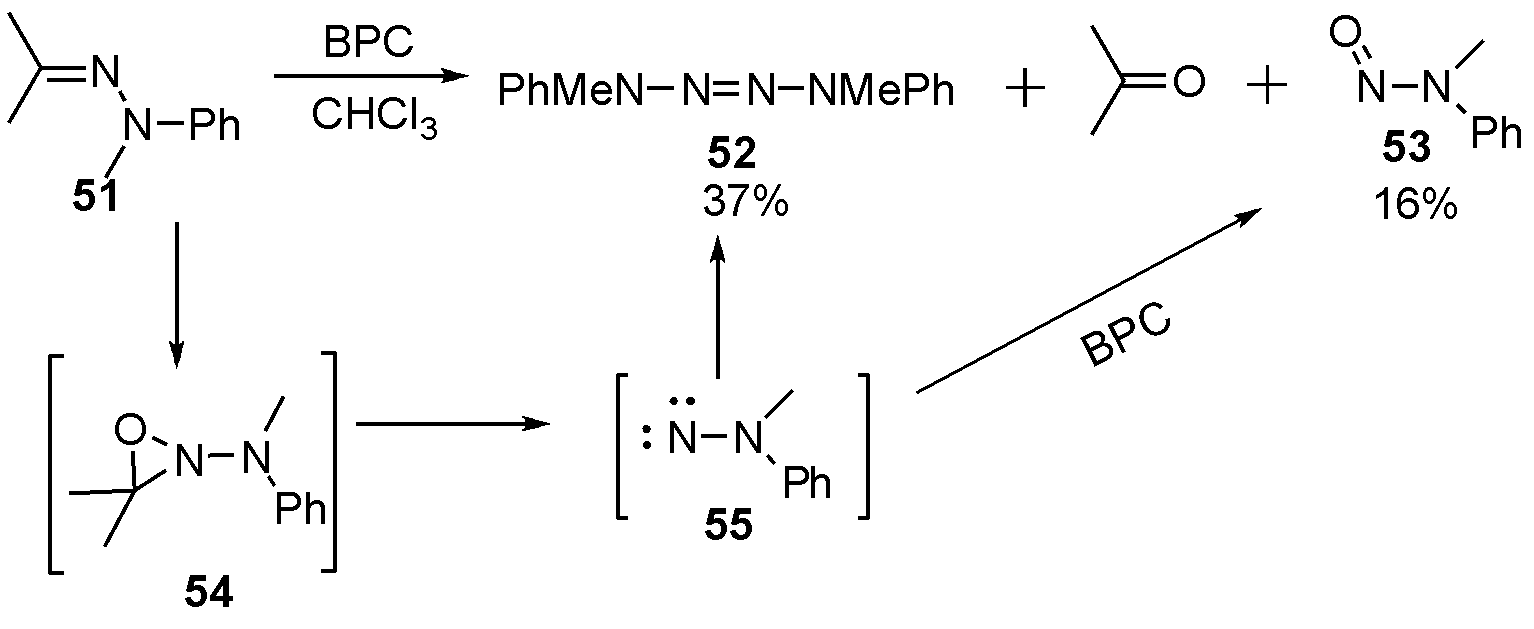
图17 利用BPC氧化腙合成2-四氮烯
Fig.17 The synthesis of 2-tetrazenes from hydrazone by BPC oxidation
1989年Hwu等[21],报道了肼类化合物56在氢化钾做碱、三甲基氯硅烷等硅烷保护肼后得到58,自发脱除三甲基硅氢,得到胺基氮烯中间体59后,氧化二聚得到四氮烯57。底物扩展如图18,产率中等。
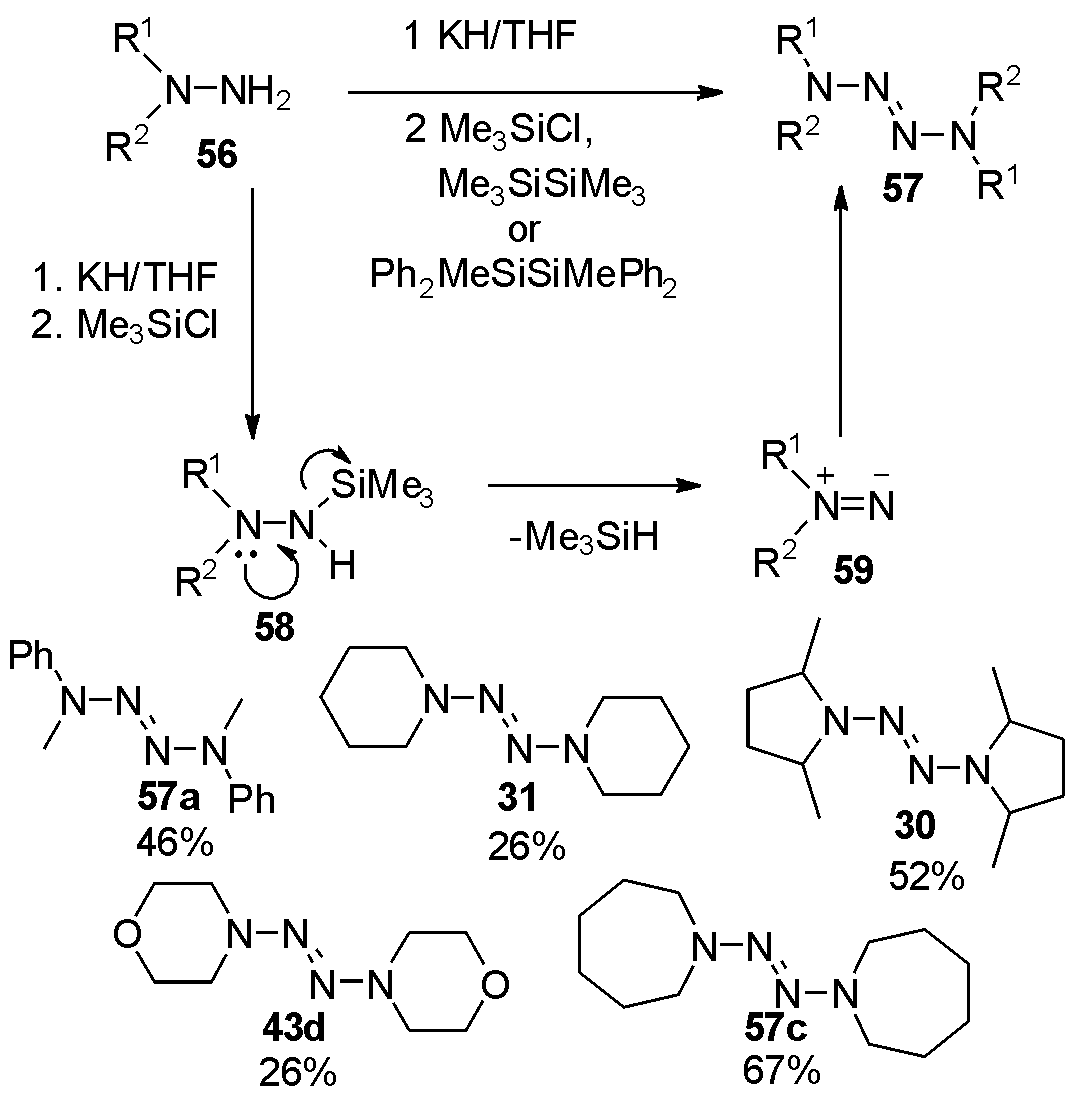
图18 利用氢化钾及硅烷合成2-四氮烯
Fig.18 The synthesis of 2-tetrazenes from protected hydrazine by potassium hydride and silane
1994年Delalu等[22],报道了在不同pH值下,五元稠环肼60在氯胺乙醚溶液中,得到不同的反应结果。在碱性pH值>13的条件下,得到重排扩环产物61。当调节pH值到弱碱性pH值≈8的条件下,得到氧化二聚产物四氮烯62,如图19。
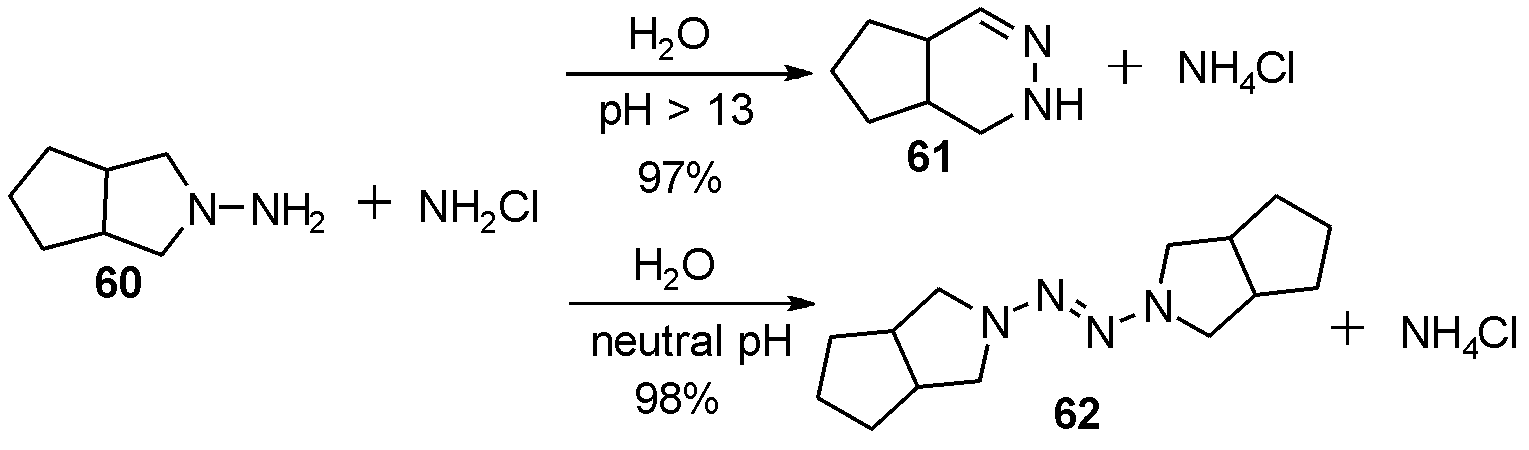
图19 不同pH值下氯胺氧化环状肼
Fig.19 Chloramine oxidizes annular hydrazine at different pH values
1994年Rademacher等[23]报道了含羟基四氮烯66和69的合成。长期以来,含羟基的四氮烯稳定性较差,推测是羟基与四氮烯络合后,降低能垒,更易脱除氮气,导致含羟基的四氮烯稳定性远不如四甲基四氮烯(TMTZ)。作者利用先保护羟基后,再通过黄色氧化汞在乙醚中氧化二聚,后期低温脱保护的策略成功得到了66和69。值得一提的是,利用红色氧化汞、不加溶剂,无需保护羟基可直接氧化得到四氮烯69,该反应也是作者研究过程中,唯一不保护羟基,直接氧化得到四氮烯的例子,如图20。
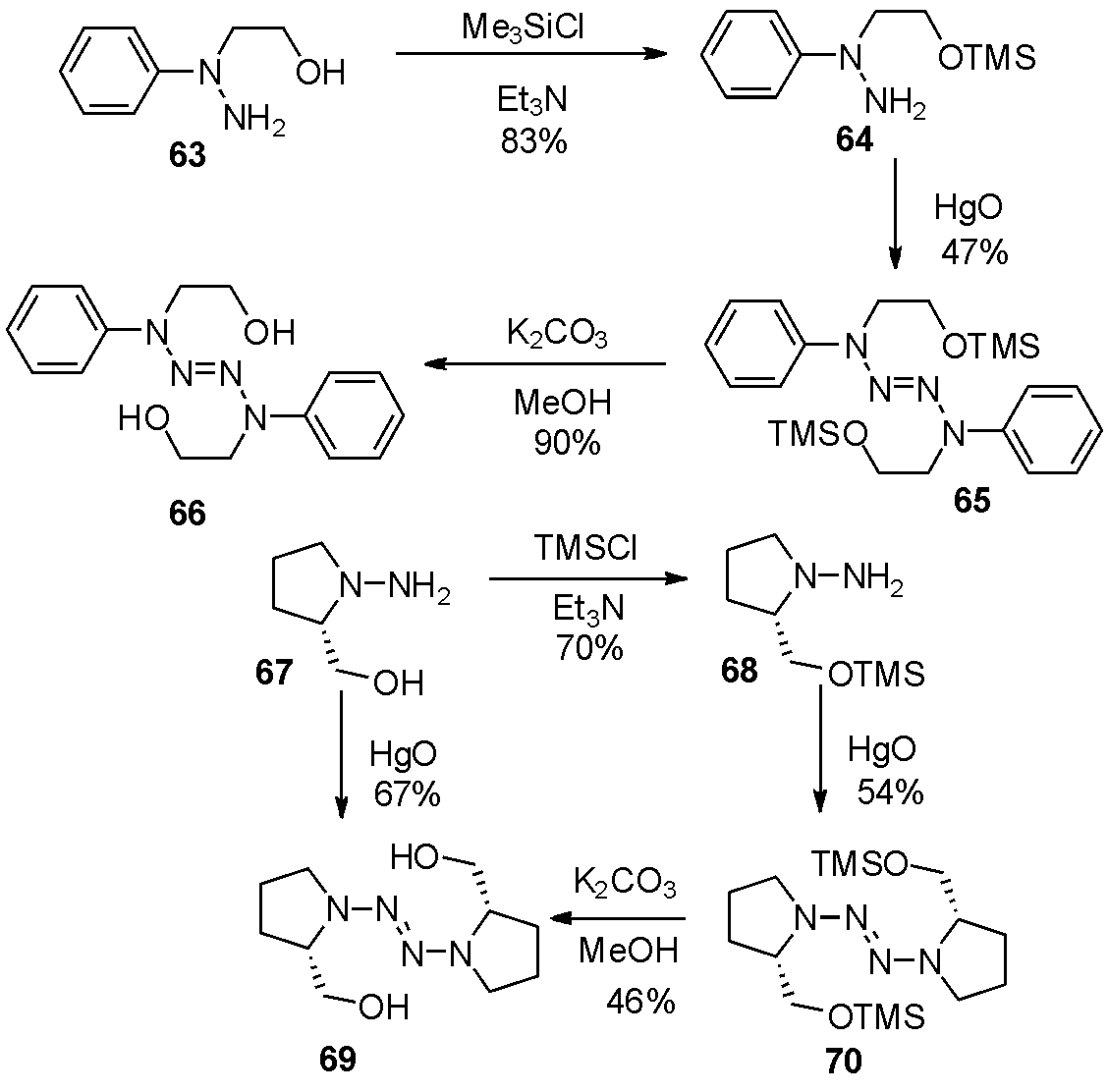
图20 利用氧化汞合成羟基四氮烯
Fig.20 The synthesis of hydroxyl tetrazenes by HgO oxidation
2020年Lac te等[24]报道了利用四氮烯为骨架合成一系列含能聚氨酯高分子化合物,该类化合物热分解温度约为130℃,玻璃化温度为-34.2~0.2 ℃。作者所用单体合成方法,主要为肼类化合物71a~d通过碘在碱性条件下氧化二聚,得到四氮烯聚合单体72a~d,如图21所示。
te等[24]报道了利用四氮烯为骨架合成一系列含能聚氨酯高分子化合物,该类化合物热分解温度约为130℃,玻璃化温度为-34.2~0.2 ℃。作者所用单体合成方法,主要为肼类化合物71a~d通过碘在碱性条件下氧化二聚,得到四氮烯聚合单体72a~d,如图21所示。
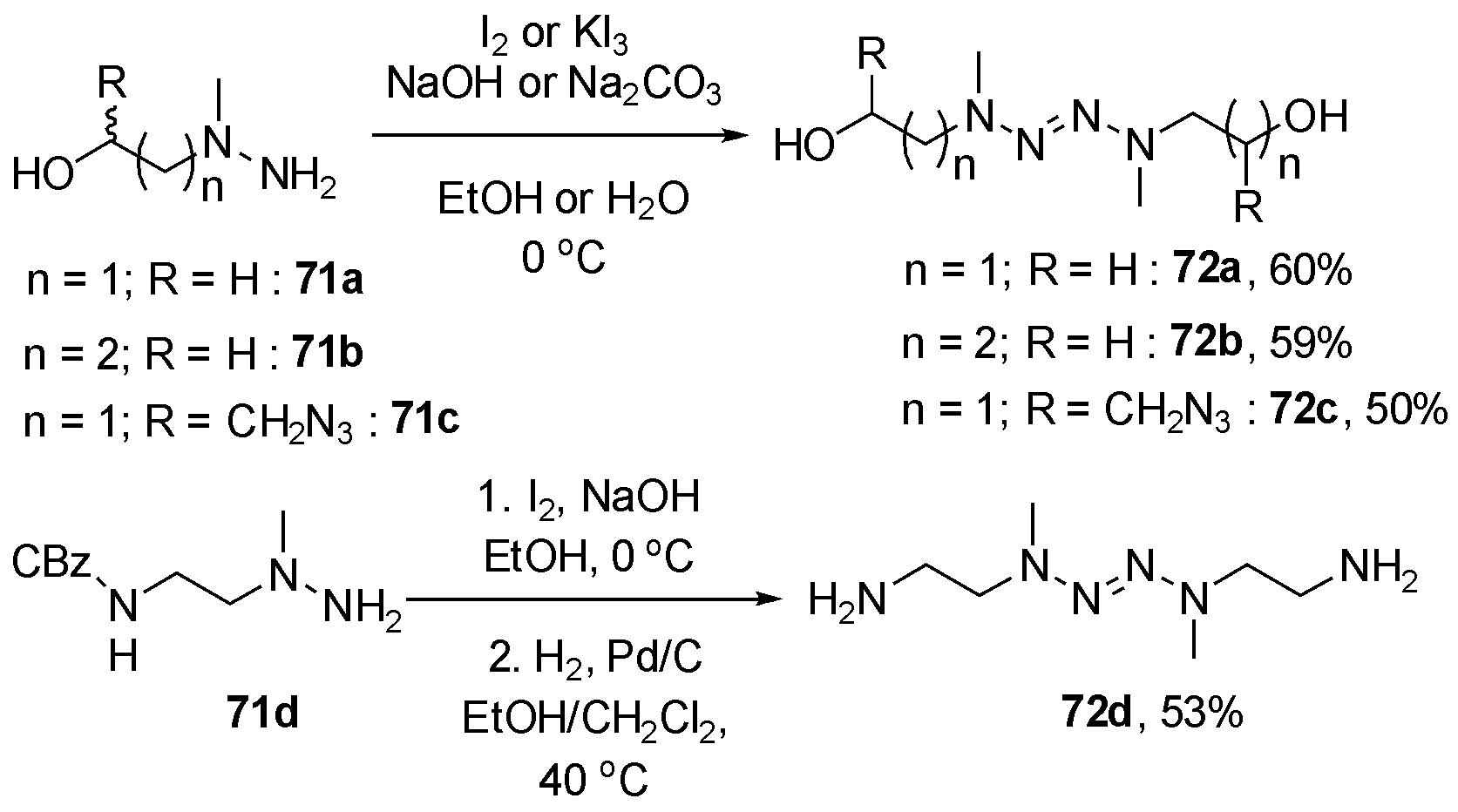
图21 利用卤素氧化偶联合成含能四氮烯单体
Fig.21 The synthesis of energetic monomer tetrazenes by halide oxidative dimerization
尽管2-四氮烯在液体推进剂中具有较好的应用前景,但截至目前的文献报道中,不同取代2-四氮烯衍生物生成焓报道极少。因此挑选以下室温液态的2-四氮烯衍生物,对其生成焓理论计算,并对其生成焓数据排序,得出取代官能团对生成焓数据影响的规律,为筛选更好的液体二元推进剂打下基础。
利用Gaussian 09中B3LYP/6-311G算法优化分子结构,通过Multiwfn计算生成焓数据。发现环状四氮烯衍生物生成焓较高;随着碳原子取代个数增加,生成焓数据逐渐下降。其中环丁胺取代四氮烯41生成焓数据最优,如表1所示。
表1 2-四氮烯衍生物生成焓计算(kJ/mol)
Table 1 The calculation of enthalpy formation of 2-tetraazene derivatives
4 N-杂环取代的2-四氮烯研究进展
含能材料的创新研究,高能量密度和高稳定性一直是关注的热点和挑战。四氮烯官能团因其较高的生成焓,有利于爆轰参数的提升,但较差的化学稳定性限制了该类型化合物的应用。如何提高稳定性,成为该类型化合物研究的重中之重。显而易见引入杂原子和大π体系,增加化合物分子氢键相互作用以及π-π堆垛效应,不失为一高效的策略。本节从饱和N杂环到唑类化合物梳理介绍,希望通过对比总结,为后续高能低感四氮烯的合成提供借鉴。此外唑类取代四氮烯在金属配合物上也有广泛的研究,由于本文聚焦四氮烯官能团的构筑,因此对四氮烯后续反应配合物的介绍,篇幅限制请参照其他文献[25-30]。
1966年Forgione等[31]报道了利用不同氧化剂,选择性得到trans或cis异构体的四氮烯。作者发现溴水,或浓硝酸中的碘酸钾,或盐酸中的溴酸钾均可以高产率得到trans-2-四氮烯74a。当使用黄色氧化汞在二氧六环或者四氢呋喃中搅拌数日,则得到cis构型的2-四氮烯74b。作者推测反应的选择性,来自于重金属汞原子与N-杂环配位,将杂环拉向同侧,从而得到cis构型四氮烯74b。光照下cis-构型74b可转化为trans-构型74a,也为作者的推测提供有力证据,如图22。
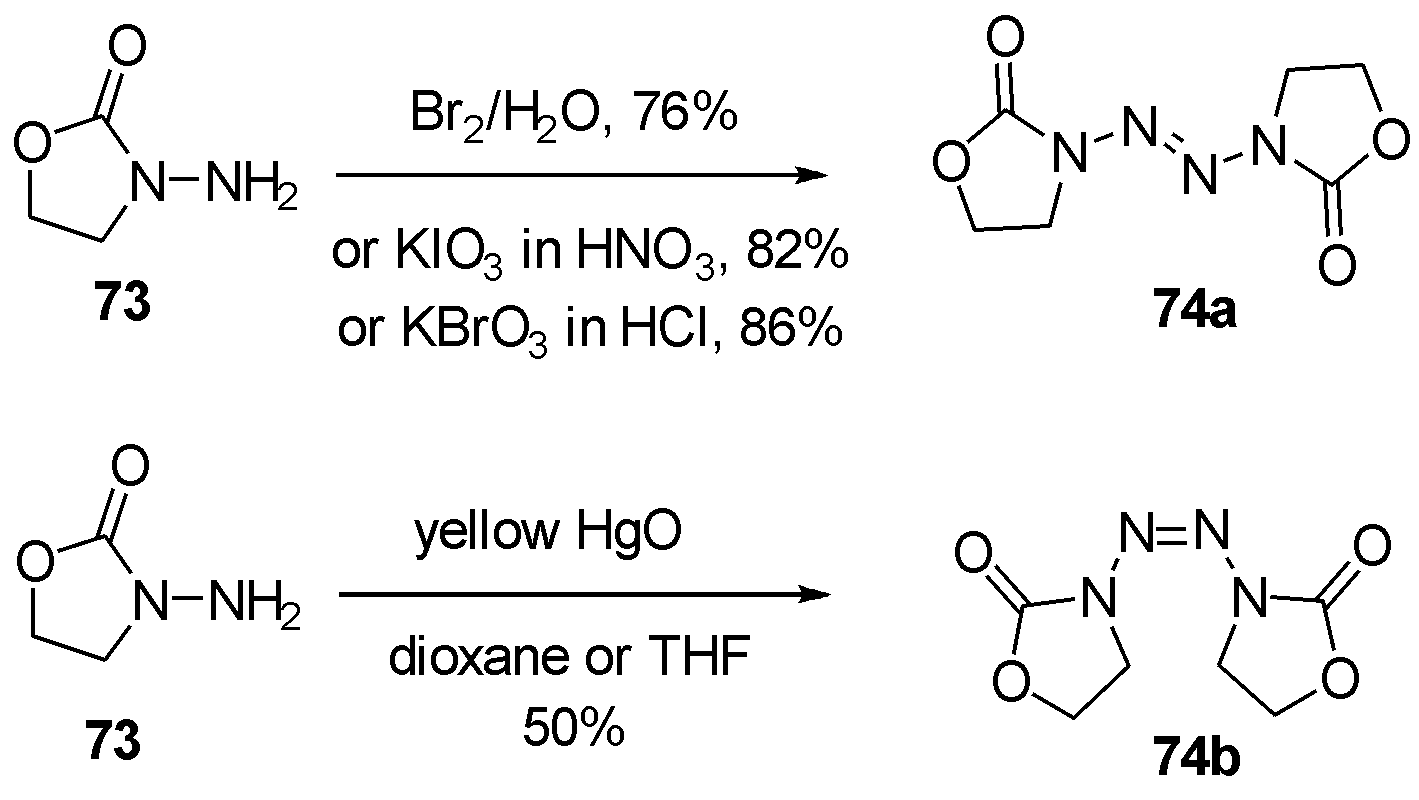
图22 不同氧化剂合成反式/顺式2-四氮烯
Fig.22 The selective synthesis of trans/cis 2-tetrazenes by different oxidants
1979年Schwan等[32]报道了利用溴水或溴酸钠合成四氮烯76的方法,与此同时也纠正了过去文献该中反应结构鉴定的错误,如图23。
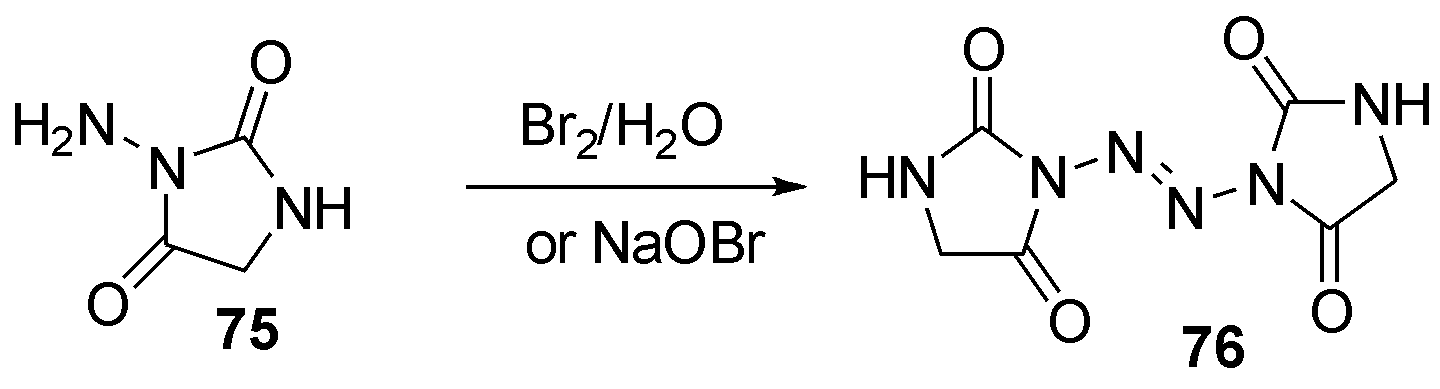
图23 N-杂环取代2-四氮烯76的合成
Fig.23 The synthesis of N-heterocyclic substituted 2-tetrazenene 76
2002年Sheremetev等[33]报道了含能基团呋咱肼化合物77在次氯酸叔丁酯中,氧化二聚为四氮烯78,如图24。遗憾的是该化合物不稳定,加热和磕碰时极易爆炸,制约了该化合物的后续探索。
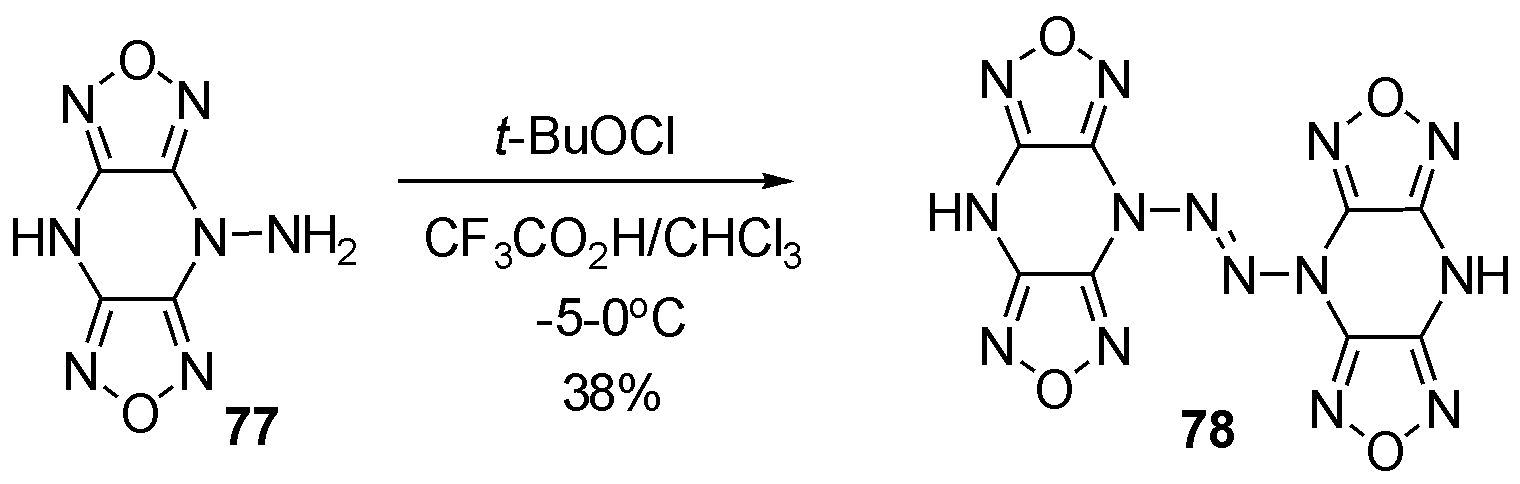
图24 呋咱取代2-四氮烯78的合成
Fig.24 The synthesis of furazan substituted 2-tetrazene 78
高含氮比唑类化合物一直是含能材料的热点。2009年Klapotke等[34]报道了四唑肼利用溴氧化偶联得到不同取代的四唑四氮烯80a和80b,对80b水解后得到80c,如图25。随后作者对三者爆炸性能进行计算,三者拥有与硝化纤维相近的爆压,但爆温显著降低,80a和80c摩擦感度<240 N,撞击感度小于5 J,而80b感度稍高。三者在推进剂领域,具有较好应用价值。
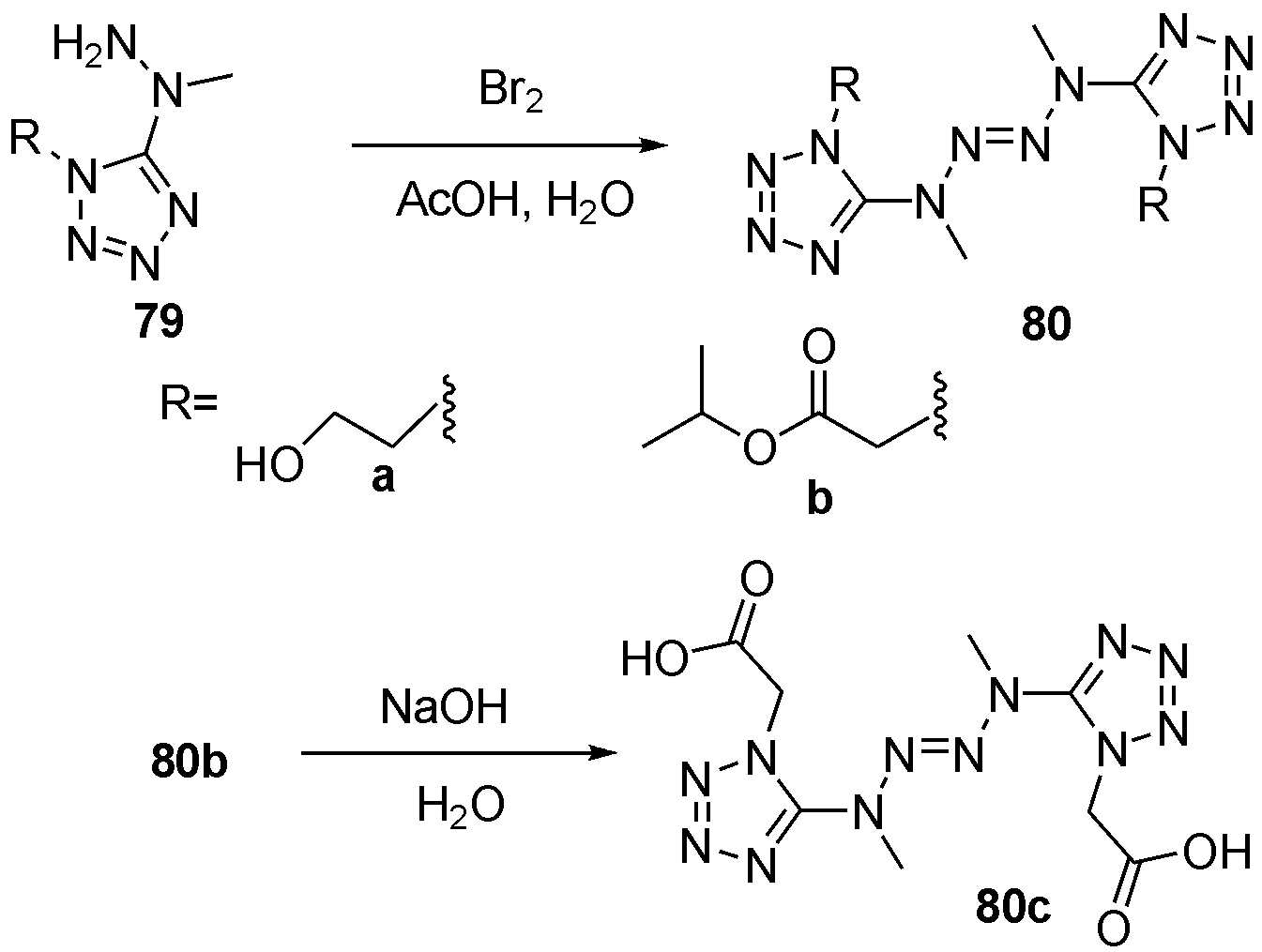
图25 四唑取代2-四氮烯80a~c的合成
Fig.25 The synthesis of tetrazole substituted 2-tetrazenes 80a~c
2011年黄洁等[35]将化合物81(ATO)用酸性高锰酸钾氧化,得到trans-2-四氮烯82(ZTO),随后与硝酸胍成盐,得到83(GTO·H2O),并用单晶验证结构,DSC测试其热稳定性。2013年[36],该小组报道了ZTO在KOH中得到钾盐84(K(ZTO)·H2O),随后加入1,10-菲罗啉(Phen)得到85(ZTO(Phen)·H2O),如图26。二者热爆炸临界温度分别为282.21 ℃和195.94 ℃。2017年[37],该小组进一步将ZTO通过甲醇钠得到二钠盐,再与硝酸胍成盐,得到热稳定性好的G2(ZTO)86,因其高氮含量、不含结晶水,在含能材料领域具有较好应用价值。
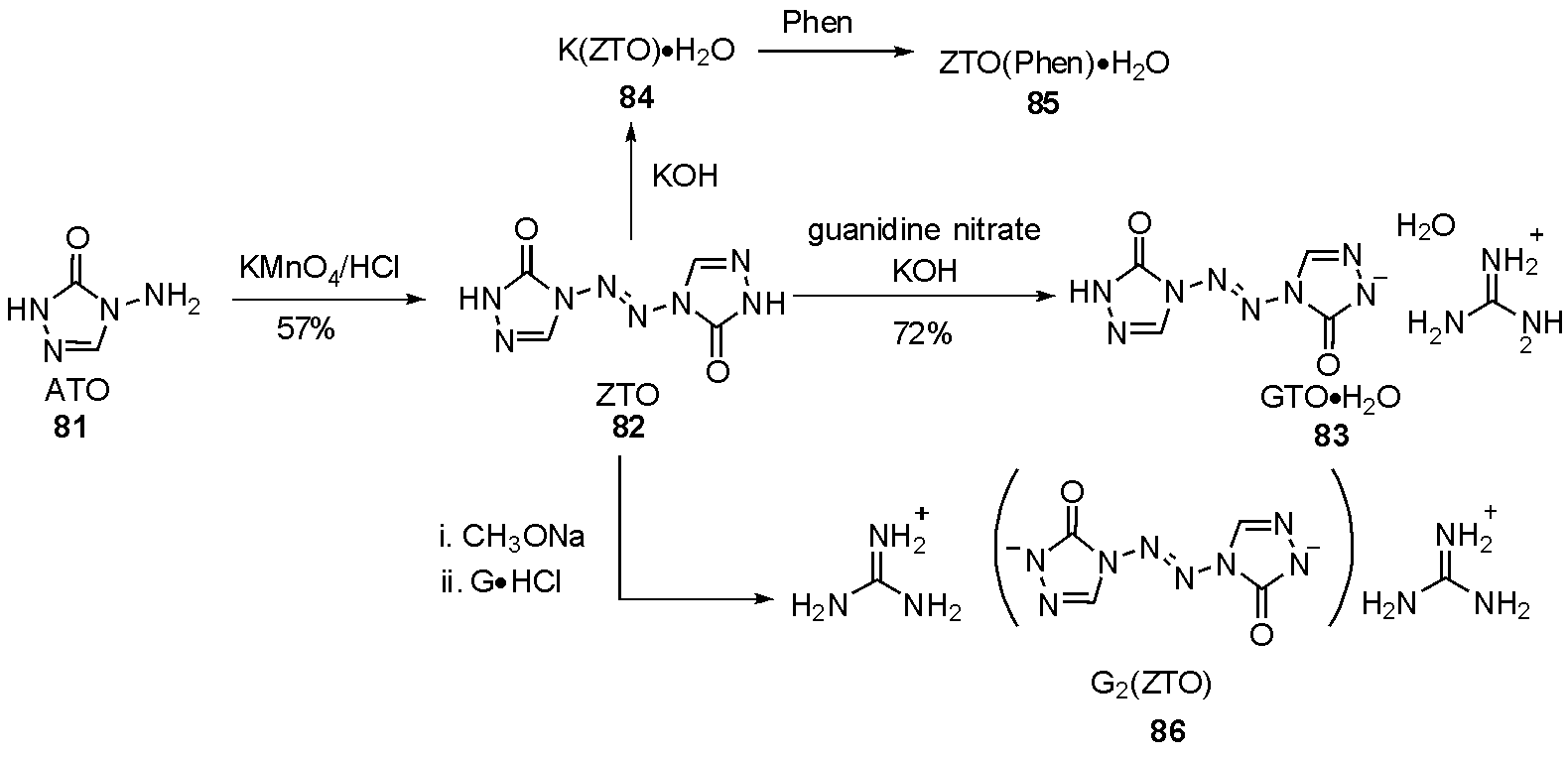
图26 黄洁组合成ZTO及其离子盐
Fig.26 The synthesis of ZTO and its energetic salts by Huang’s group
2016年Zhu等[38]报道了利用1,3-二氨基脲87出发,与原甲酸三乙酯缩合关环得到ATO后,利用高锰酸钾得到四氮烯ZTO。与不同碱反应后,得到9种三唑四氮烯的盐88~96,如图27。并对其进行表征,该类化合物均具有出色的热稳定性、高密度、良好的爆震性能,对撞击不敏感(H50>60 cm)。其中化合物91、95和96性能较好,有望成为新型的高能量不敏感材料。
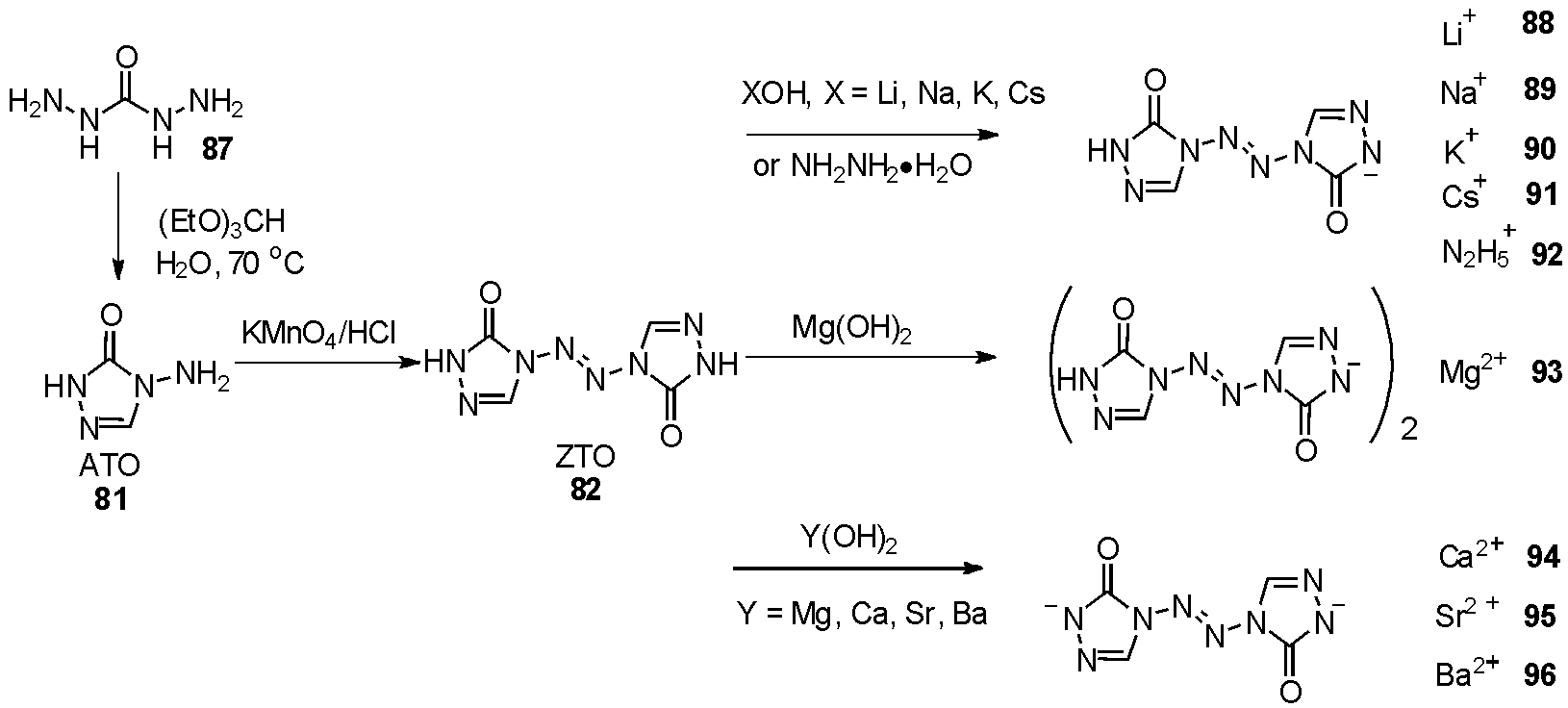
图27 Zhu小组合成ZTO及其金属离子盐
Fig.27 The synthesis of ZTO and its energetic metal salts by Zhu’s group
2012年庞思平等[39]报道了从4-氨基-1,2,4-三氮唑97出发,集群式合成不同取代的三氮唑四氮烯的方法。作者利用二氯异氰尿酸钠(SDCI)进行氧化偶联得到四氮烯98,通过控制NCS当量得到1~4个氯原子取代的99~102,随后过量的叠氮化钠处理,得到103~106。通过Staudinger反应将叠氮转化为胺基,得到化合物107~110,盐酸水解后得到胺基衍生物111~114,如图28。尽管111~114通过胺基的分子内氢键使化合物撞击感度>40 J,但叠氮基的缺失,导致其爆轰参数显著降低。
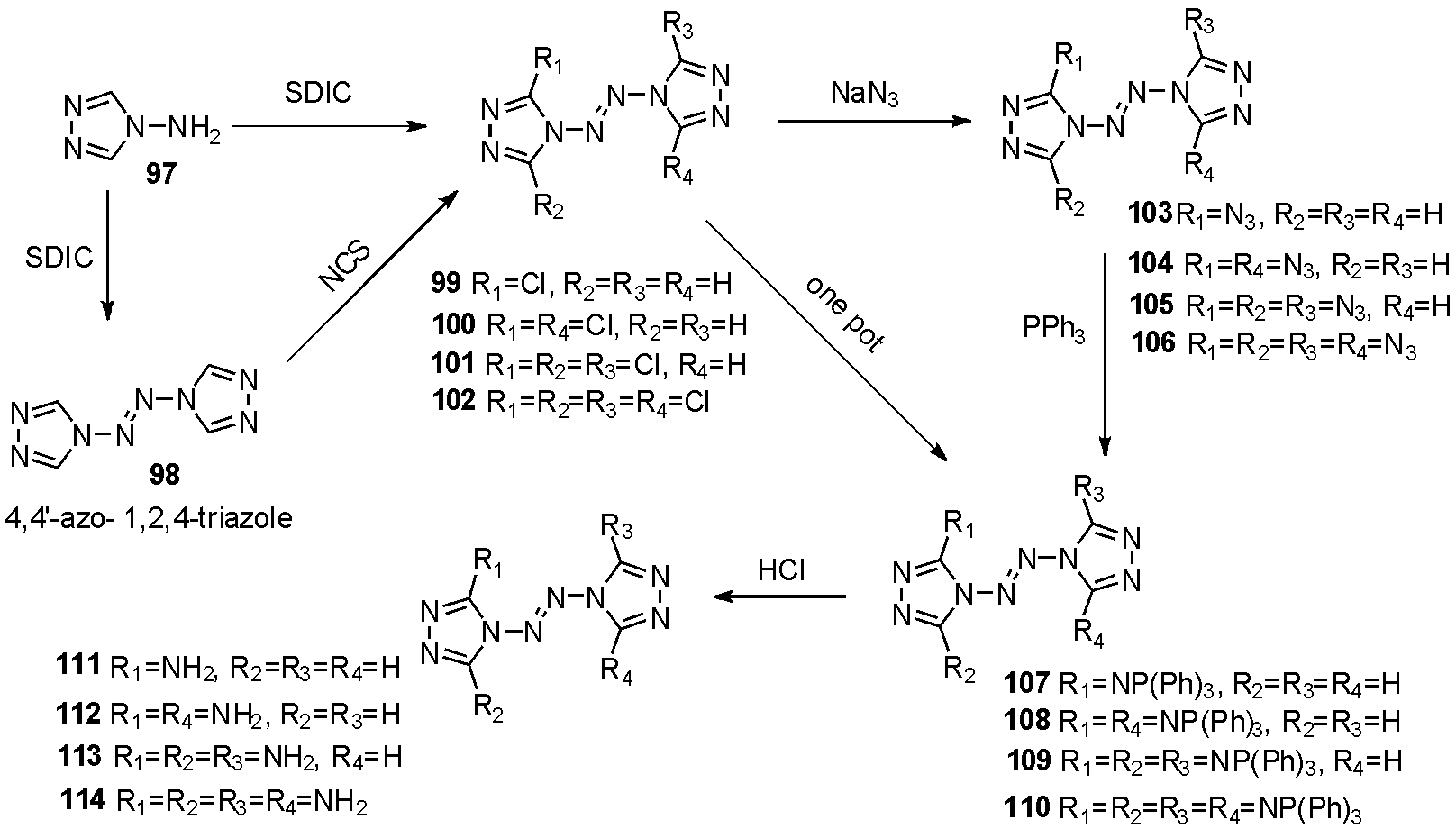
图28 集群式合成三唑四氮烯
Fig.28 The cluster synthesis of triazoltetrazenes
2014年Shreeve等[40]报道了从氨基唑116出发,利用SDCI氧化偶联得到一系列的不同取代唑类四氮烯117a~i,如图29。感度测试显示117a~117c,117f、117h的撞感较高(2~10 J),N4化合物117d、117e、117g则撞感良好(10~25 J)(这类化合物撞感和摩感文献中是否给出标准物同等测试条件下的测试值,如果有请补充)。爆炸参数计算显示117a~117i的爆压在24.9~35.6 GPa,爆速在7 632~8 979 m/s(RDX为35.2 GPa和8997 m/s)。其中化合物117e,感度良好,爆轰性能超过RDX(没有看到117e的测试数据,从文中看爆速应该在7 632~8 979 m/s,爆速没有超过RDX),具有较好的应用前景。
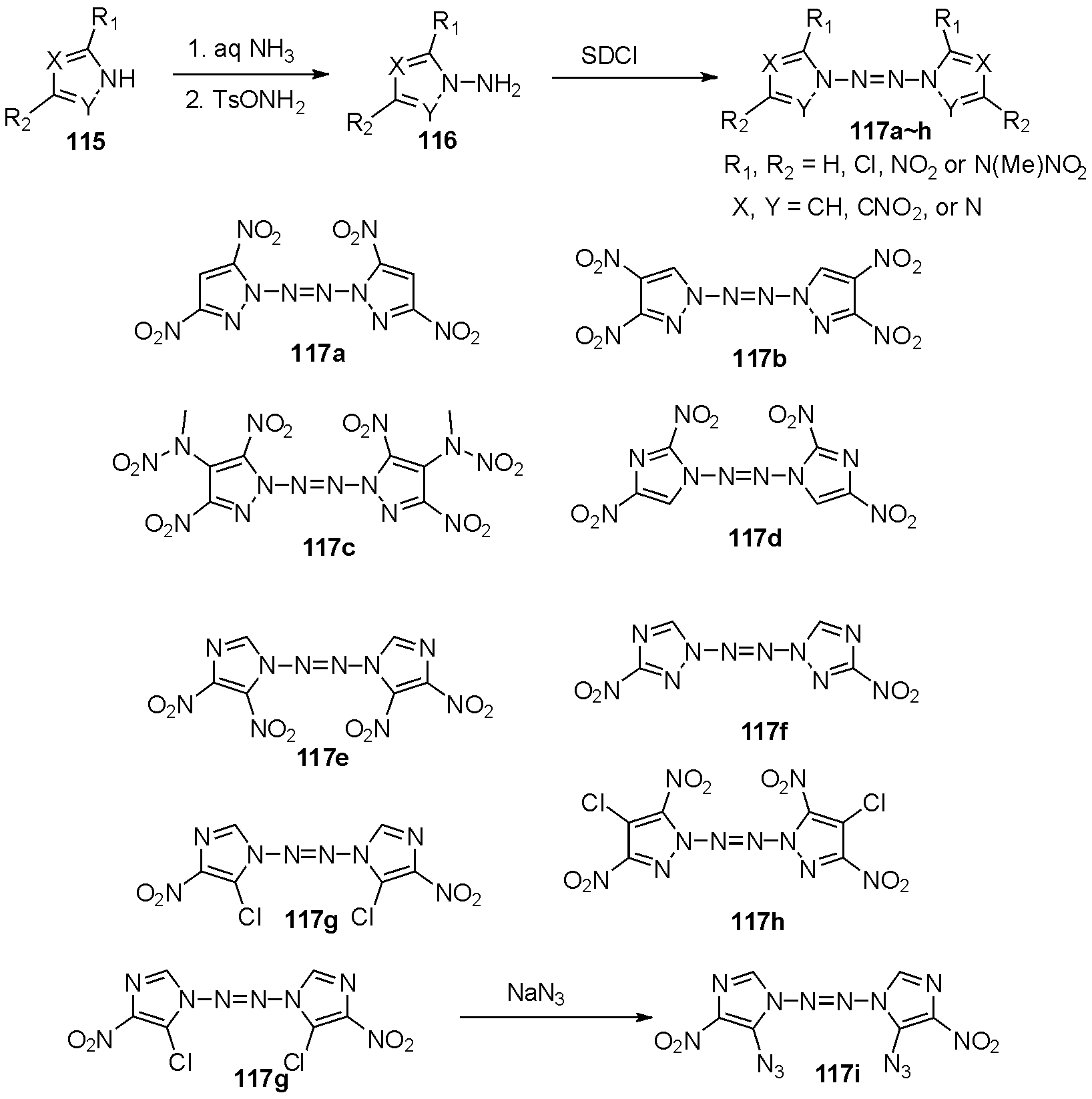
图29 硝基唑取代2-四氮烯的合成
Fig.29 The synthesis of nitroazolo substituted 2-tetrazenes
2015年Shreeve等[41]报道了从1,2,4-三唑118出发,利用SDCI氧化偶联得四氮烯119,通过不同官能团修饰,得到了3种唑类取代四氮烯119、120、123,如图30。对其进行爆炸参数计算,化合物119拥有较好的感度(撞感>40 J,摩感>360 J)及良好的爆轰性质,化合物120拥有较好的爆轰性质(爆速8 194 m/s),但感度一般。
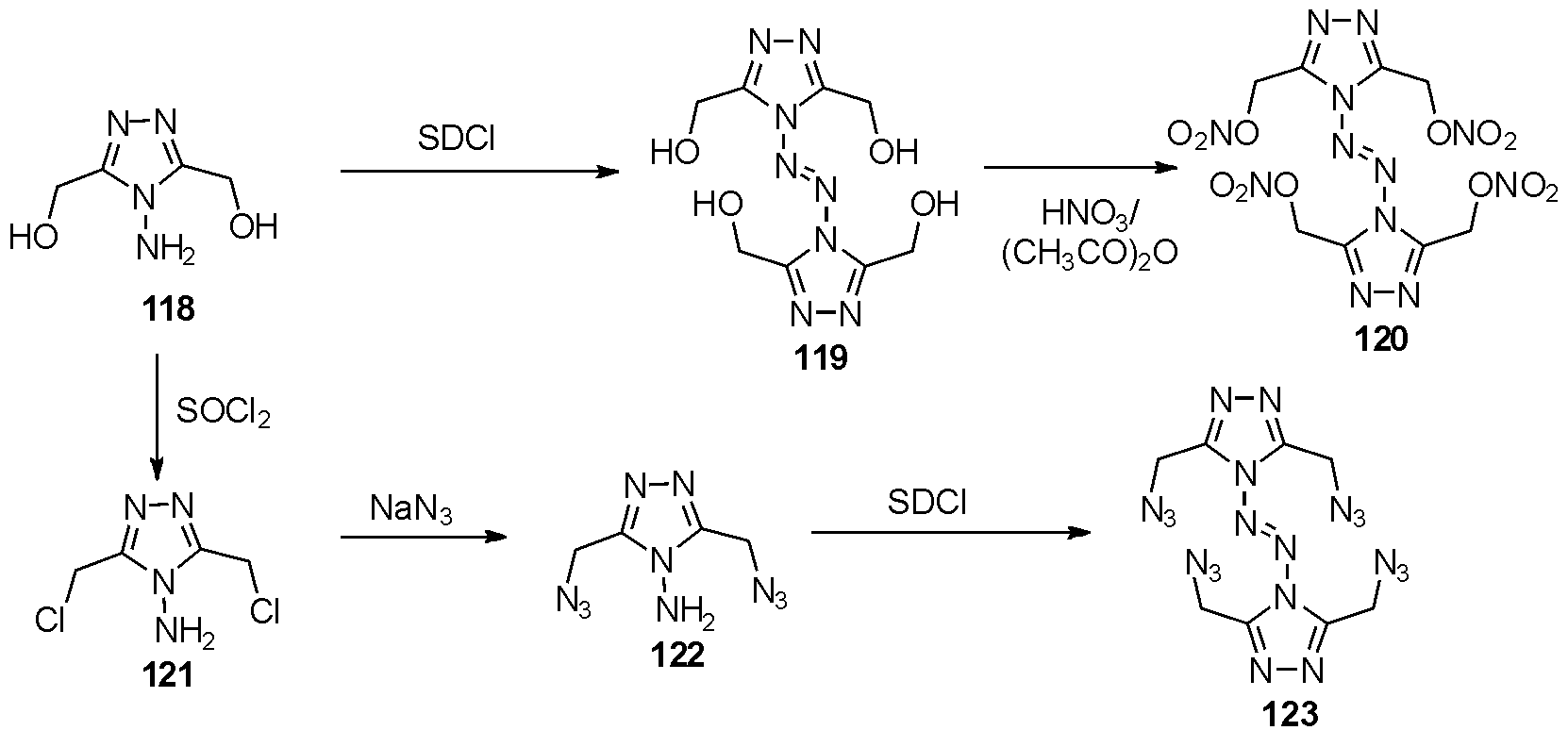
图30 羟基,硝酸酯和叠氮三唑取代的2-四氮烯的合成
Fig.30 The synthesis of hydroxyl,nitrate ester and azido triazole substituted 2-tetrazenes
2021年Lu等[42]报道了从三氨基胍盐酸盐124出发,通过与甲酸或者溴化氰缩合得到化合物125和多一个胺基的126,随后在高锰酸钾氧化得到三氮唑并环的四氮烯127和128。由于化合物中氮原子较多,化合物呈碱性,因此简单酸碱中和后得到不同含能阴离子盐129~132,如图31。性能表征显示,该类型化合物热分解温度高(均高于210 ℃),感度较低(撞感32~40 J、摩感320~360 N),较好的爆轰性能(爆速7 633~8 677 m/s、爆压24.1~36.1 GPa),其中化合物131各项数据最优(热分解温度275 ℃,爆速8 677 m/s、爆压36.1 GPa、撞感40 J、摩感360 N),由此可见将高能量的四氮烯官能团与不敏感唑类结合起来,是平衡高能量密度和低感较好的策略。
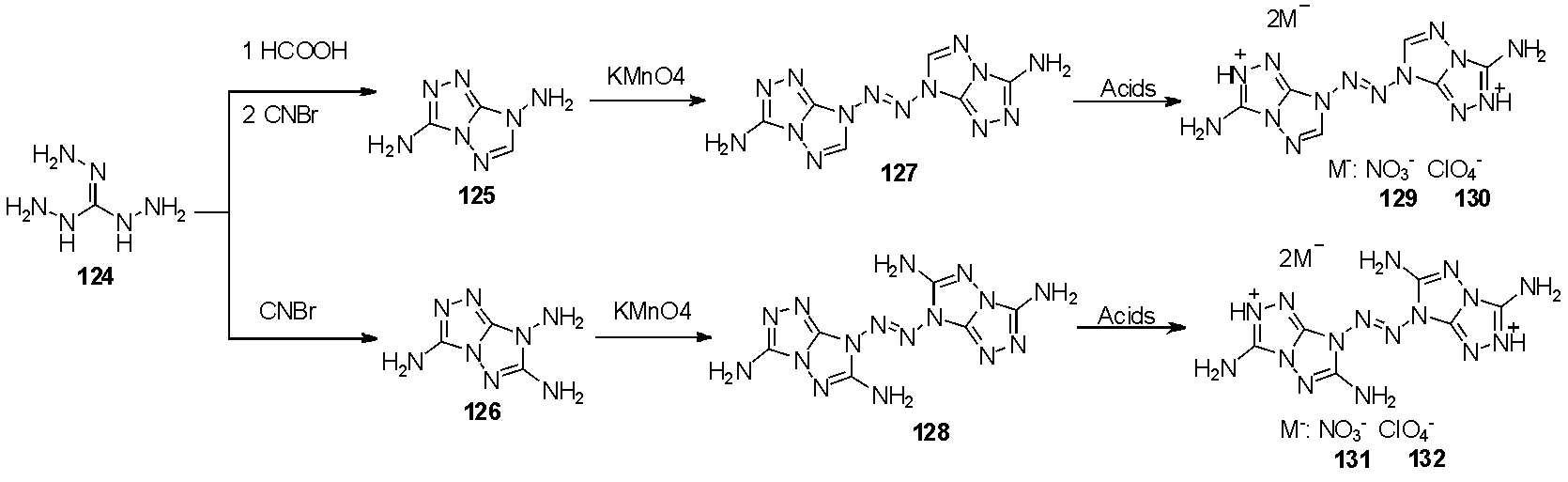
图31 稠合双环三唑取代的2-四氮烯的合成
图31 The synthesis of fused-bicyclic triazolo substituted 2-tetrazenes
5 结论
1)四氮烯(tetrazene)作为一种高生成焓、分解产物清洁无污染的氮链官能团,具有较高的氮/碳比,在航空航天、武器装备等领域的应用具有较大潜质。
2)在推进剂应用方面,四甲基四氮烯已成为替代高毒、低沸点肼类化合物的优异候选化合物。
3)在火炸药应用方面,除了作为起爆药以外,四氮烯作为N4结构的链接官能团(N4[N-N=N-N]linkage),可将唑类、呋咱等含能化合物连接起来,得到不敏感、爆轰性能更佳的炸药。
4)四氮烯化合物目前的合成策略均为传统化学氧化,合成策略单一;其衍生物取代基团绝大部分为烷烃和N-杂环,构效关系有待深入研究。
[1] 朱勇,丁可伟,肖川,等.含能材料合成中的氮链扩增方法[J].火炸药学报,2021,44(01):21-29.
Zhu Y,Ding K W,Xiao C,et al.Amplification methods of nitrogen chains in the synthesis of energetic materials[J].Chinese Journal of Explosives &Propellants (Huozhayao Xuebao),2021,44(01):21-29.
[2] Li L C,Shang J,Liu J L,et al.A G3B3 study of N4H4 isomers[J].Journal of Molecular Structure Theochem,2007,807(1/3):207-210.
[3] Wiberg N,Chem D,Bachhuber H,et al.Isolierung von tetrazen,N4H4[J].Angewandte Chemie,1975,87:202-203.
[4] Sheng H L,Pang S P,Li X T,et al.Synthesis of new tetrazene (N-N=N-N)-1inked bi(1,2,4-triazole)[J].Chinese Chemical Letters,2007,18(10):1176-1178.
[5] Dhenain A,Darwich C,Sabaté C M,et al.(E)-1,1,4,4-Tetramethyl-2-tetrazene (TMTZ):A prospective alternative to hydrazines in rocket propulsion[J].Chemistry,2017,23(41):9879-9907.
[6] McBride W R,Kruse H W.Alkylhydrazines.I.Formation of a new diazo-like species by the oxidation of 1,1-dialkylhydrazines in solution[J].Journal of the American Chemical Society,1955,79(03):572-576.
[7] Lemal D M,Rave T W,Mcgregor S D.The decomposition of certain 1,1-disubstituted 2-arenesulfonylhydrazine salts[J].Journal of the American Chemical Society,2002,85(13):1944-1948.
[8] Sabaté C M,Jeanneau E,Delalu H.Energetic ionic compounds based on the 2-tetrazenium cation[J].European Journal of Inorganic Chemistry,2012,2012(14):2418-2428.
[9] Laetitia G,Christelle M,Myléne H,et al.Metabolomics and cytotoxicity of monomethylhydrazine (MMH)and (E)-1,1,4,4-tetramethyl-2-tetrazene (TMTZ),two liquid propellants[J].Toxicology in Vitro,2018,52:70-86.
[10] Iwamura M,Hintz P J,Nelsen S F.1,4,7,10-Tetramethyl-1,2,3,4,7,8,9,10-octaazacyclododeca-2,8-diene.cyclic bis-2-tetrazene[J].Journal of the American Chemical Society,1970,92(11):3495-3496.
[11] Seebach D,Dach R,Enders D,et al.1,4,5,6-Tetrahydro-ν-tetrazin-derivate[J].Helvetica Chimica Acta,1978,61(05):1622-1647.
[12] Lemal D M,Rave T W,Mcgregor S D.The decomposition of certain 1,1-disubstituted 2-arenesulfonylhydrazine salts[J].Journal of the American Chemical Society,2002,85(13):1944-1948.
[13] Bhatnagar I,George M V.Oxidation with metal oxides.III.oxidation of diamines and hydrazines with manganese dioxide[J].Journal of Organic Chemistry,1968,33(06):449-457.
[14] Hoesch L,Dreiding A S.Phthalimido-nitren i.bleitetraacetat-oxydation von N-aminophthalimid in inerten losungsmitteln.bildung und eigenschaften von trons-l,4-bisphthaloyl-2-tetraze[J].Helvetica Chimica Acta,1975,58(04):980-1001.
[15] Karl K,Lüttke W,Rademacher P.Synthese und Konformationsverhalten von 1,1′-Biazetidinyl[J].Angewandte Chemie,2010,90(09):726-727.
[16] Back T G,Kerr R G.Oxidation of 1,1-disubstituted hydrazines with benzeneseleninic acid and selenium dioxide.Facile preparation of tetrazenes[J].Canadian Journal of Chemistry,1982,60(21):2711-2718.
[17] Heesing H,Ludwig K.2,3-Umlagerung von 2-aza-in 2,3-diazabicyclen bei redoxreaktionen ihrer N-nitroso-und N-amino-derivate[J].Chemische Berichte,1986,119(04):1413-1423.
[18] Milcent R,Guevrekian-Soghomoniantz M,Barbier G.Synthesis of new N-aminoaziridine derivatives by the addition of dibenzyloxycarbonylaminonitrene to olefins[J].Cheminform,2010,23(06):1845-1848.
[19] Soon,W,Lee,et al.Generation of mono-and dianions of 1,4-diphenyl-2-tetrazene by nonoxidative N-N bond formation.A novel route to a 2-tetrazene,a silacyclotetrazene,and the tetrazenide complex (1,4-diphenyltetrazenido)bis(triethylphosphine)palladium[J].Journal of the American Chemical Society,1987,109(16):5050-5051.
[20] Paredes R,Bastos H,Montoya R,et al.The reactions of n-benzoylperoxycarbamic acid with azines and imines[J].Tetrahedron,1988,44(22):6821-6830.
[21] Hwu J R,Wang N,Yung R T.Chlorotrimethylsilane,hexamethyldisilane,and 1,2-dimethyl-1,1,2,2-tetraphenyldisilane as oxidizing agents in the conversion of hydrazines to 2-tetrazenes.Trimethylsilyl anion as a leaving group[J].Journal of Organic Chemistry,1989,54(05):1070-1073.
[22] Delalu H,Khatib M E,Marchand A.Formation of 3,4-diazabicyclo[4,3,0]non-2-ene and N,N′-azo-3-azabicyclo[3,3,0]octane by oxidation of an alicyclic hydrazine.influence of pH on the diazene rearrangement[J].Monatshefte Für Chemie,1994,125(10):1113-1120.
[23] Porath B,Münzenberg R,Latz R,et al.First synthesis and investigation of two hydroxyalkyl-substituted 2-tetrazenes[J].European Journal of Organic Chemistry,2010,1998(07):1431-1440.
[24] Eymann J,Joucla L,Jacob G,et al.Energetic Nitrogen-Rich Polymers with a Tetrazene-Based Backbone[J].Angewandte Chemie,2020,133(3):1602-1606.
[25] Gehrmann T,Fillol J L,Wadepohl H,et al.Synthesis,characterization,and thermal rearrangement of zirconium tetraazadienyl and pentaazadienyl complexes[J].Organometallics,2012,31(12):4504-4515.
[26] Li S,Wang Y,Qi C,et al.3D energetic metal-organic frameworks:Synthesis and properties of high energy materials[J].Angewandte Chemie,2013,52(52):14031-14035.
[27] Li Y L,Wu B D,Yang L,et al.Energetic materials composed of coordination polymers:{[Zn(μ-atrz)3](ClO4)2·2H2On and {[Cu(μ-atrz)3](NO3)2·2H2On[J].Journal of Coordination Chemistry,2014,67(11):2016-2027.
[28] Ding B,You Y W,Shi X L,et al.A series of multi-dimensional metal-organic frameworks with trans-4,4′-azo-1,2,4-triazole:polymorphism,guest induced single-crystal-to-single-crystal transformation and solvatochromism[J].Cryst Eng Comm,2015,17:5396-5409.
[29] Xu J G,Sun C,Zhang M J,et al.Coordination polymerization of metal azides and powerful nitrogen-rich ligand toward primary explosives with excellent energetic performances[J].Chemistry of Materials,2017,29(22):9725-9733.
[30] Yao D,Su H,Fei T,et al.Structure-property relationship in energetic cationic metal-organic frameworks:new insight for design of advanced energetic materials[J].Crystal Growth &Design,2018,18(10):5896-5903.
[31] Forgione P S,Sprague G S,Troffkin H J.Stereospecific oxidation of a 1,1-disubstituted hydrazine via metal ion coordination.a new approach to isomeric azo compounds[J].Journal of the American Chemical Society,1966,88(05):3021-3022.
[32] Schwan T J,Sanford T J.The dehydrogenation of the alleged hexahydro-1,2,4-triazine-3,6-dione[J].Journal of Heterocyclic Chemistry,2010,16(08):1655-1656.
[33] Sheremetev A B,Yudin I L.Unusual oxidation of 4-amino-4 H,8 H-bisfurazano[3,4-b:3′,4′-e ]pyrazines[J].Cheminform,2002,12(39):66-67.
[34] Heppekausen J,Klap?tke T M,Sproll S M.Synthesis of functionalized tetrazenes as energetic compounds[J].Journal of Organic Chemistry,2009,74(06):2460-2466.
[35] Zhong Y,Huang J,Song J,et al.Synthesis,crystal structure and thermal behavior of GZTO·H2O[J].Chinese Journal of Chemistry,2011,29(8):1672-1676.
[36] Cong M,Jie H,Yi T Z,et al.Preparation,structural investigation and thermal decomposition behavior of two high-nitrogen energetic materials:ZTO·2H2O and ZTO(phen)·H2O[J].Bulletin-Korean Chemical Society,2013,34(07):2086-2092.
[37] Cao W L,Guo J J,Chen X,et al.Synthesis,characterization,thermal properties and theoretical investigation on bis(guanidinium)4,4′-azo-1 H-1,2,4-triazol-5-one[J].Journal of Molecular Structure,2017,1147(05):754-762.
[38] Zhu J,Jin S,Wan L,et al.Nitrogen-rich 4,4′-azo bis(1,2,4-triazolone)salts—the synthesis and promising properties of a new family of high-density insensitive materials[J].Dalton Transactions,2016,45(8):3590-3598.
[39] Cai Q,Li S H,Pang S P,et al.Synthesis and promising properties of a new family of high-nitrogen compounds:polyazido-and polyamino-substituted N,N′-azo-1,2,4-triazoles.[J].Chemistry-A European Journal,2012,18(51):16562-16570.
[40] Yin P,Parrish A D,Shreeve J M.N-diazo-bridged nitroazoles:catenated nitrogen-atom chains compatible with nitro functionalities[J].Chemistry-A European Journal,2014,20(22):6707-6712.
[41] Tang Y X,Shreeve J M.Nitroxy/azido-functionalized triazoles as potential energetic plasticizers[J].Chemistry,2015,21(19):7285-7291.
[42] Li X,Sun Q,Lu M,et al.[N-N=N-N]-linked fused triazoles with π-π stacking and hydrogen bonds:towards thermally stable,insensitive,and highly energetic materials[J].Chemical Engineering Journal,2021,406(15):126817.
[43] Wiberg N,Uhlenbrock W.Zur thermolyse von bis(trimethylsilyl)-diimin;einige bemerkungen zur thermischen zersetzung von azoverbindungen[J].Journal of Organometallic Chemistry,1974,70(02):239-248.
[44] Wiberg N,Uhlenbrock W.1,1,4,4-tetrakis(trimethylsilyl)tetrazene[J].Angewandte Chemie International Edition,1970,82(01):47.
Research progress in synthesis of tetrazene derivatives
Citation format:WANG Kunkai,LI Xiangzhi,YANG Kaidi,et al.Research progress in synthesis of tetrazene derivatives[J].Journal of Ordnance Equipment Engineering,2022,43(03):1-10.
